 金牌会员
金牌会员
 已认证
已认证
多肽药物缓释微球制剂及其制备方法
大多数的蛋白、多肽类药物,口服生物利用度很低,以致口服后不能产生 足够高的有效血药浓度,这类药物不能通过口服途径给药。皮下注射时由于体 内蛋白酶的存在,药物在体内的半衰期很短,需要频繁注射,增加了患者的痛 苦,降低患者依从性。
利用生物相容性可降解材料(例如高分子材料)包裹药物活性成分,制成 微球制剂,通过可降解的生物高分子材料在体内逐步降解来控制药物释放,维 持有效的血药浓度。然而,大多数微球制剂都存在很高的药物突释现象以及此 后的低释,造成血药浓度过高或者低于有效血药浓度。此外,在微球制剂生产 过程中很容易造成生物活性药物成分活性降低或降解,对于多肽类药物来说尤 其如此。因此,需要一种新的制剂和工艺来改善这类缓释制剂的突释及维持释 放期间的有效血药浓度。
用于制备载微球的方法很多,一般根据载体材料和药物的性质选择最优的方法,常规的微球制备方法有乳化-溶剂挥发法、相分离法、喷雾干燥法、 膜乳化法等。此外,还有许多新方法如盐析法、高压匀质法,新技术如纳米技术、微流控技术和超临界流体技术等1。
1、乳化-溶剂挥发法
微球制备最常用的方法是乳化-溶剂挥发法,其原理是将原辅料先分别溶于两种互不相溶的溶剂中,再通过机械振荡或超声乳化的方法制成乳剂,被分散成乳滴的液体为内分散相,分散乳滴的液体为外连续相,然后使内分散相溶剂在一定条件下挥发除去,成球材料析出,固化成微球2。
一种多肽药物缓释微球的制备方法,
(1)将聚乳酸-羟基乙酸共聚物或聚乳酸溶于有机溶剂中,形成浓度为 100~800mg/mL的溶液;所述聚乳酸-羟基乙酸共聚物中乙交酯∶丙交酯 =15∶85~90∶10,所述聚乳酸-羟基乳酸共聚物的分子量为2000~65000;所述聚乳 酸的分子量为4000~50000;所述有机溶剂为二氯甲烷、三氯甲烷、乙酸乙酯、 丙酮、乙酸、乙腈中的一种或几种;
(2)分别按10~500mg/ml和10~200mg/ml的浓度,将多肽药物和保护剂溶 于无菌水中,得到多肽药物溶液,所述保护剂为糖、糖醇类、蛋白类、无机盐、 高分子稳定剂中的一种或几种;
(3)按体积比为1∶5~50将步骤(1)的聚乳酸-羟基乙酸共聚物溶液或聚乳酸溶 液与步骤(2)的多肽药物溶液混合,搅拌至形成均一、澄清、透明的混合液;
(4)配制含0.5~5wt%稳定剂的油相,所述油相选自大豆油、花生油、玉米 油、芝麻油、矿物油、二甲基硅油、棉籽油、橄榄油、椰子油、橘油、脂肪烃、 环脂烃或芳香烃中的一种或几种;所述稳定剂选自卵磷脂、span80、单硬脂酸甘 油酯或双硬脂酸聚甘油酯;油相作用是作为乳液连续相,为了保持乳液两相稳 定,油相中需加入一定量的稳定剂。稳定剂的含量影响最终微球粒径的大小。 稳定剂含量越高,乳化时形成的乳滴越小,最终得到的微球粒径越小。
(5)按体积比1∶2~50将步骤(3)的混合液与步骤(4)的油相均质形成O/O型乳 液;形成乳液的方法有机械搅拌(时间3~15min)、高压均质或高剪切均质等。 两相比及两相间的表面张力影响最终微球粒径大小。有机相与油相体积比越大, 对应得到的微球粒径越大。
(6)挥发步骤(5)的乳液除去有机溶剂,待有机溶剂完全挥发干净后,离心收 集微球,加入环己烷洗涤,除去微球中残留的有机溶剂,把收集到的微球放入 真空冷冻干燥器干燥4~10h,得到多肽药物缓释微球制剂,置于-20℃保存。
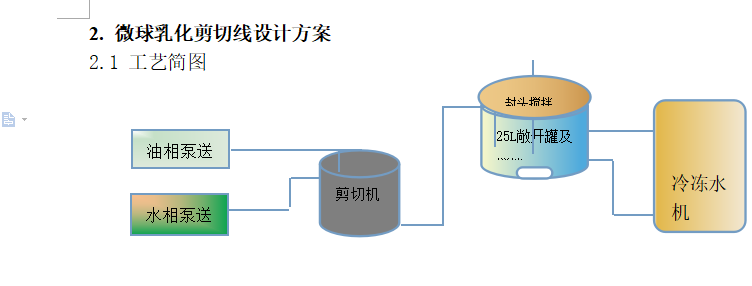
关键影响参数:
油水比
表面活性剂类型
表面活性剂浓度
微球分子量大小
不同设备及转速影响
此法具有包封率高、操作方法简便、重现性好、无需特殊设备等优点,但易受所包载药物的理化性质等因素的影响。根据乳剂类型不同通常又可将其分为单乳法(O/W、W/O)和复乳法(W/O/W、O/W/O)两大类,单乳法常用来包载水不溶性药物,而复乳法则用来包载水溶性且性质不太稳定的药物。
多肽药物缓释微球制剂及其制备方法 单乳法(O/W、W/O)和复乳法(W/O/W、O/W/O)两大类,单乳法常用来包载水不溶性药物,而复乳法则用来包载水溶性且性质不太稳定的药物



