 白金会员
白金会员
 已认证
已认证
无论是在学术研究领域还是在生物制药工业中,选择合适的启动子实现高效的蛋白生产,在菌种和工艺开发中都起着至关重要的作用。研究表明甲基营养酵母多形汉逊酵母(Hansenula polymorpha 或 Ogataea polymorpha)和毕赤酵母(Pichia pastoris)是异源基因表达的有效宿主微生物,可大规模生产各种重组蛋白。它们之所以具有吸引力,还因为它们使用甲醇作为唯一的碳源,需要一套独特的代谢酶,其生产受到严格控制 。[1] 由于其独特的特性,汉逊酵母广泛用作重组蛋白生产的表达宿主:首先,相比有些哺乳动物的蛋白需要在37°C保持其生物活性,汉逊酵母菌具有耐热性,有利于哺乳动物蛋白的生产。其次,蛋白质糖基化途径的存在,使真核重组蛋白生产成为可能,同时可以避免过度糖基化。第三,其利用甲醇作为碳源的能力允许分离出强甲醇诱导型启动子。此外,多形汉逊酵母菌还可利用诸如甘油、葡萄糖、木糖、纤维二糖等其他碳源。[2]
多形汉逊酵母菌能在甲醇培养基中产生大量醇氧化酶和甲醇代谢所需的其他酶。因此,形成酶的液泡充满了细胞的大部分胞内空间。研究人员利用这种独特的性质,通过将目的基因连接至醇氧化酶基因实现外源蛋白表达。[3] 将外源基因连接至醇氧化酶基因的启动子,可获得高水平重组蛋白。[1] 形汉逊酵母菌在理想培养条件下,使用甲酸脱氢酶(FMD)或甲醇氧化酶(MOX)等强启动子可获得超高蛋白滴度。甲基营养酵母的强分泌能力与成熟的高细胞密度发酵技术相结合,可使外源蛋白分泌量高达每升数克。[4] 这两种启动子均被葡萄糖或乙醇强烈抑制,而被甲醇作为唯一碳源高度诱导。如果甘油或葡萄糖的补料低于细胞生长限制速率,则MOX启动子不受抑制。[1]
在本应用中,我们使用微型生物反应器BioLector探索汉逊酵母获得高产量的绿色荧光蛋白(GFP)所需的PH条件。在本高通量发酵研究中,我们研究含有 FMD 和 MOX 启动子的多形汉逊酵母菌种,以确定高效蛋白生产所需的首选 pH 范围。截至目前,研究表明在小规模培养系统中低 pH 范围 4-6 非常难以测定和控制。这里,光学 pH 传感器是首选的测量系统。使用普通的传感器往往只能在生理 pH 范围内提供可靠的结果。在本研究中,我们将近期发布的低pH传感器集成至 BioLector中,以便进行可靠的非侵入式pH 筛选,实现发酵过程 pH 控制,提高蛋白生产效率。pH通过微孔板(MTP)中的微流控芯片控制,并在红外光谱范围进行光学测量,以减少培养基中背景荧光的干扰。这使得BioLector高通量微型发酵平台可在低 pH 条件下使用荧光报告基因(如 GFP)跟踪整个发酵过程的蛋白表达。
方法
菌株
多形汉逊酵母RB11 MOX-GFP 菌株和 RB11 FMD-GFP 菌株
培养基
葡萄糖为碳源的无氨基酸酵母氮源培养基中(YNB-D)培养:含有1.34g/L 酵母氮源、5g/L (NH4)2SO4和20g/L葡萄糖。此外,使用不同浓度(100mM、50mM 和 25mM)的磷酸盐缓冲液(pH 6.0)
培养条件
在BioLector中采用微流控梅花板进行培养。振摇速度1200rpm,温度为 30°C。每孔培养体积 800µL。以 3M NaOH和3M HCl作为pH调节剂,通过微流控芯片在pH 4 –6范围内双向调节pH。
在线测量参数
生物量、GFP、pH和溶氧
结果
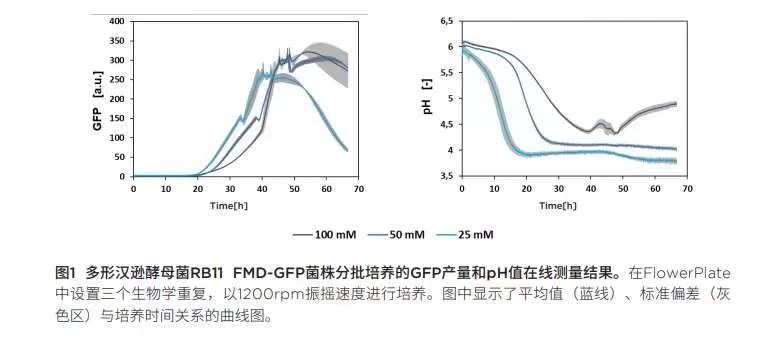
在不同缓冲液浓度的YNB-G培养基中进行分批培养:通过预筛选实验研究GFP对培养基中磷酸盐缓冲液浓度和未调节pH值的依赖趋势。为此,在YNB-D中将汉逊酵母菌RB11 FMD-GFP 菌株进行分批培养,磷酸盐缓冲液浓度调节为25mM、50mM 或 100mM。GFP产量、pH值与培养时间的关系如图1所示。只要培养基中含有葡萄糖,FMD启动子就会受到抑制,因此当葡萄糖含量低或被完全消耗时,就会诱导GFP表达。正如预期,培养基缓冲液浓度越低,pH值下降越快。相比,低缓冲液浓度培养基中GFP产生的时间比高缓冲液浓度培养基更早。一个原因可能是低缓冲液浓度培养基渗透压更低,培养条件更好,从而获得更高的GFP产量。另一个原因可能是因为低缓冲液浓度培养基的pH值下降更快,而这种低pH的环境在代谢生产力方面是更好的。
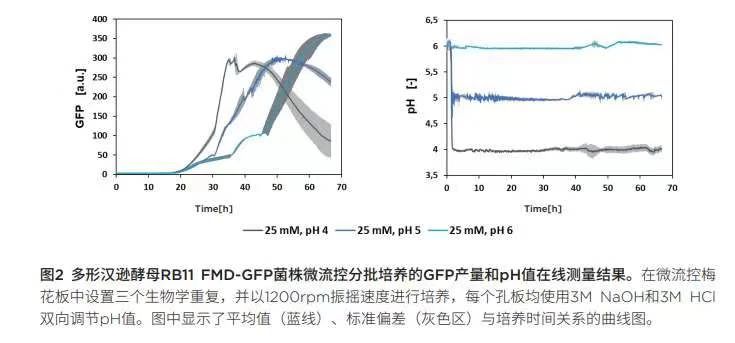
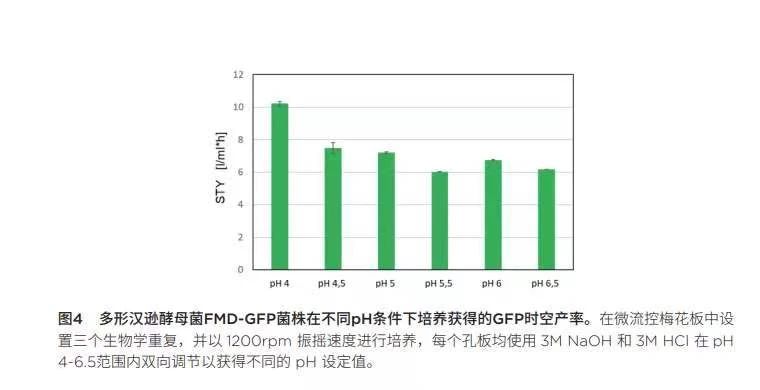
进行pH分析以寻求GFP高效表达的最佳条件:在接下来的多形汉逊酵母菌RB11 FMD-GFP菌株分批培养实验中,使用缓冲液浓度为25mM的培养基,并在培养过程中通过BioLector的微流控芯片技术调控pH值。我们分析了pH在4.0- 6.5范围的GFP 表达性能。图 2显示三组培养实例中GFP合成和pH控制情况。从初步分批培养实验中可以看出,pH设定值越低,GFP开始表达的时间就越早。此外,pH设定值越低,GFP信号的斜率越陡。请注意,在这里GFP只是目的蛋白质的替代物,由于GFP在较低pH范围内不稳定[5],GFP在pH为4时的降解速度比在较高pH值时要快得多,因此这里只能作定性比较。
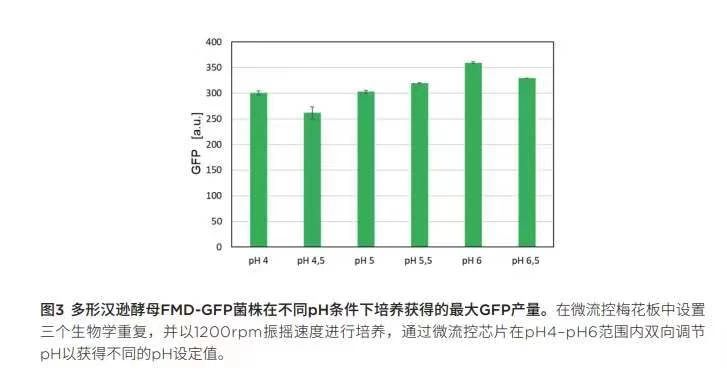
仔细观察最大GFP信号(图 3)以及随后计算GFP表达的时空产率(图 4),每一项根据调整的PH设定值绘制,证实了GFP在较低PH条件下表达较高的假设。尽管PH值为6时获得最强GFP 信号(359.35 a.u.),但GFP表达的时空产率(STY)仍呈现随PH增大而降低的趋势。pH为4.0时获得最高STY 10.24 I/mL*h。请注意,GFP 只是目的蛋白质的替代物,由于GFP在较低PH范围内不稳定[5],GFP 在PH为4时的降解速度比在较高PH值时要快得多。
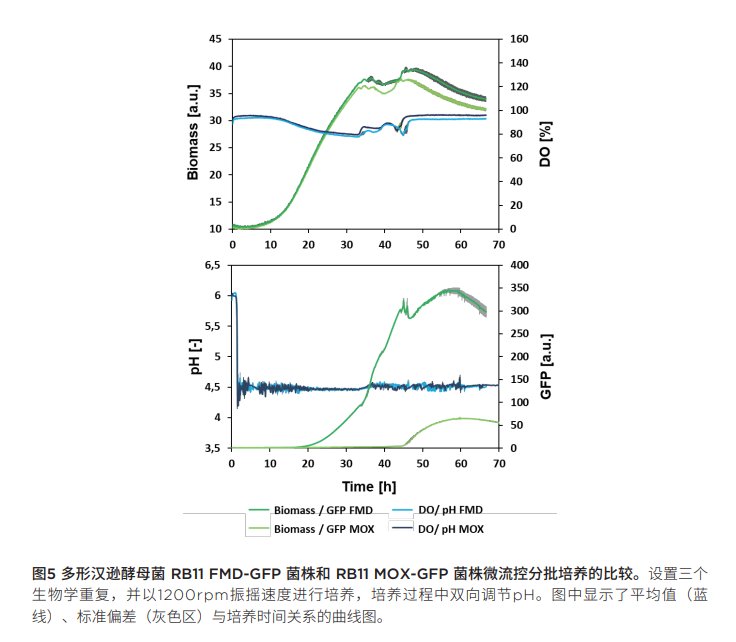
评估不同启动子:对多形汉逊酵母RB11 FMD-GFP菌株和RB11 MOX-GFP菌的培养数据进行比较,评估pH设定值固定为4.5的情况下GFP表达所用FMD和MOX 启动子的特性。图5为两种株菌生物量和DO信号以及pH、GFP值与培养时间关系的曲线图。从生物量和DO曲线上可看出,两种菌株具有相似的生长行为。但是,GFP信号可以发现,多形汉逊酵母菌RB11 FMD-GFP菌株的GFP信号高出7倍。
结论
采用BioLector进行生物量、GFP、pH 和 DO 的非侵入式在线测量,可成功筛选出多形汉逊酵母蛋白表达的 pH 和菌株。本研究发现,较低pH 值和FMD 启动子有利于 GFP 的表达(GFP 代表目标蛋白质)。此外,基于BioLector的微流控技术,可在一块微孔板上同时进行多达32个不同条件的平行发酵以筛选汉逊酵母生产重组蛋白的最佳培养条件。
参考文献[1] Raschke, W., Neiditch, B., et al. (1996) Inducible expression of a heterologous protein in Hansenula polymorpha using the alcohol oxidase 1 promoter of Pichia pastoris. Elsevier Science Gene 177, 163-167. [2] Manfrão-Netto, J., Gomes, A. and Parachin, N. (2019) Advances in Using Hansenula polymorpha as Chassis for Recombinant Protein Production. Front. Bioeng. Biotechnol. 7:94. doi: 10.3389/fbioe.2019.00094 [3] Kurtzman, C. & Robnett, C. (2010) Systematics of methanol assimilating yeasts and neighboring taxa from multigene sequence analysis and the proposal of Peterozyma gen.nov., a new membe rof the Saccharomycetales. FEMS Yeast Res 10, 353–361. [4] Hartner, F. & Glieder, A. (2006) Regulation of methanol utilisation pathway genes in yeasts. Microbial Cell Factories, 5:39. doi:10.1186/1475-2859-5-3 [5] Campbell, T. & Choy, F. (2001) The Effect of pH on Green Fluorescent Protein: A Brief Review, Molecular Biology Today 2 (1), 1-4.


