钻石会员
钻石会员
 已认证
已认证
摘要:
目的:不溶性微粒是临床输液安全性评估的重要指标。本研究旨在评价抗生素不同包装对小粒径范围(<10 μm)不溶性微粒分布的影响,为解释临床不良反应和指导合理用药提供依据。
方法:采用常规光阻法和单颗粒光学传感(SPOS)技术测定不同厂家不同包装(双腔袋和小瓶)复溶注射液中不溶性微粒的粒径分布。为了验证我们的假设,控制原料药(API)和溶剂一致,避免两者对结果的影响。此外,利用扫描电子显微镜(SEM)观察不同包装注射剂的不溶性微粒的形态特征。
结果:复溶后,双腔袋包装的粉针剂溶液中小粒径不溶性微粒(<10 μm)明显低于西林瓶包装的常规粉针剂。SEM观察到的结果也证明了两种包装形式之间不溶性微粒的数量差异,显示出装在瓶中的氯化钠溶解制剂中的不溶性微粒数量较多,且形状不规则。
结论:在我们的研究中,不溶性微粒分布的差异主要归因于包装形式。双腔袋注射可能是减少不溶性微粒引起的不良反应的有效替代方案。
《临床使用静脉输液基本评价指南》提出的18项评价指标中,不溶性微粒是临床输液安全性评价中最重要的指标之一。2020年版《中国药典》(ChP 2020),仅对注射剂中粒径大于10 μm的亚可见颗粒设定了限定,并没有对较小颗粒提出具体要求。但人体最细的毛细血管直径为 4-7 μm,>8 μm 的颗粒可能会被困在肺部,而 <8 μm 的颗粒可能会沉积在肝脏、脾脏和骨髓中。因此,小粒径(<10 μm)不溶性微粒。
Walpot等人在研究中观察到的大多数微血栓与直径小于2 μm的颗粒(玻璃、乳胶和聚合物)有关,这些颗粒污染物构成了静脉液体中的大部分颗粒污染物。此外,动物模型也展示了小粒径不溶性微粒物的不利影响。Stehbens和Florey将直径在0.2-0.5μm之间的颗粒静脉注射到兔子体内,发现了与血小板和中性粒细胞相关的闭塞性微血栓。
复旦大学沙先谊老师采用常规光阻法和单颗粒光学传感(SPOS)技术测定不同厂家不同包装(双腔袋和小瓶)复溶注射液中不溶性微粒的粒径分布。旨在评价抗生素不同包装对小粒径范围(<10 μm)不溶性微粒分布的影响,为解释临床不良反应和指导合理用药提供依据。
1 实验材料
A制剂:注射用头孢唑林钠/氯化钠注射液(双腔袋包装,1.0g/100mL;苏州大冢制药有限公司,中国苏州);
B制剂:注射用头孢唑林钠(小瓶包装,每瓶0.5g,厂家1);
C制剂:注射用头孢唑林钠(小瓶包装,每瓶0.5g,厂家2);
2 实验方法
1. 制备方法
双腔袋包装注射液不溶性微粒样品制备方法:
按照药品说明书溶出操作方法,将两室内容物混合,确认粉剂完全溶解至获得临床药物溶液。
小瓶包装注射液不溶性微粒样品制备方法:
用 10 mL 无菌注射器(KDL 一次性无菌注射器,浙江康德莱医疗器械有限公司,中国杭州)将 5 mL 氯化钠注射液注入摇匀溶解1分钟,制成药粉复溶溶液。将1瓶(1g/瓶)或2瓶(0.5g/瓶)复溶用注射器移液至同一个氯化钠注射液瓶(100mL)中,混合均匀,得到临床药液。
上述样品的制备是在生物安全柜下完成的。
2. 不溶性微粒检测
①AccuSizer A2000 SIS不溶性微粒仪(PSS,美国加利福尼亚州圣巴巴拉)检测不溶性微粒,AccuSizer 780 A2000 SIS 的参数如下:
检测方法:SPOS
测定温度:23℃
检测体积:5 mL
检测传感器:LE400-05
检测模式:Sum模式
检测范围:0.5–500 μm
标准颗粒:SIS Tri Mix STD(2 和 5μm)标准颗粒
②LS-200 不溶性微粒仪(PMS,博尔德,科罗拉多州,美国)检测不溶性微粒,LS-200的参数如下:
检测方法:光阻法
测定温度:23℃
测定体积:5 mL
③扫描电子显微镜(SEM,Nova NanoSEM 450,FEI,Hillsboro,OR)对不溶性微粒形态进行表征。
样品制备过程如下:将复溶后的头孢唑林钠注射液经0.22 μm过滤器过滤,用水冲洗滤膜收集供试样品进行颗粒测试。然后,首先将 100 μl不溶性微粒悬浮液铺在盖玻片上,在室温下干燥过夜。使用离子溅射机(SBC-12,KYKY,北京,中国)喷涂金属涂层3分钟。
仪器参数设置如下:
加速电压:1 kV,
工作距离:4.6 mm
探测器:背散射探测器(CBS)
3 实验检测结果
1. LS-200 不溶性微粒仪 VS AccuSizer A2000 SIS不溶性微粒仪
光阻法结果(LS-200 不溶性微粒仪)如表1所示,双腔袋A制剂小粒径范围内的颗粒数显着低于小瓶包装B制剂(p<0.001),光阻法只能检测≥2μm的不溶性微粒。SPOS结果(AccuSizer A2000 SIS不溶性微粒仪)显示,三个厂家的不溶性微粒在各个粒径范围内均存在显着差异,双腔袋A制剂小粒径范围内的颗粒数量明显低于小瓶包装的两种制剂 B 和 C (p < 0.001)。不同厂家包装形式的头孢唑林钠注射液溶液中不溶性微粒对比见表2、表3,粒径分布及对比见图1、图2。

表1 头孢唑啉钠复溶后不同粒径的不溶性微粒的比较(n=12)

表2三个不同制造商的复溶溶液中不溶性微粒的测定结果 (n = 45)。

表3头孢唑林钠复溶后不同粒径的不溶性微粒的比较(n =45)

图 1. (A) A 制剂、(B) B 制剂和 (C) C 制剂复溶后不溶性微粒的分布。(D) (0.5–10 μm)显示了不溶性微粒分布的比较。
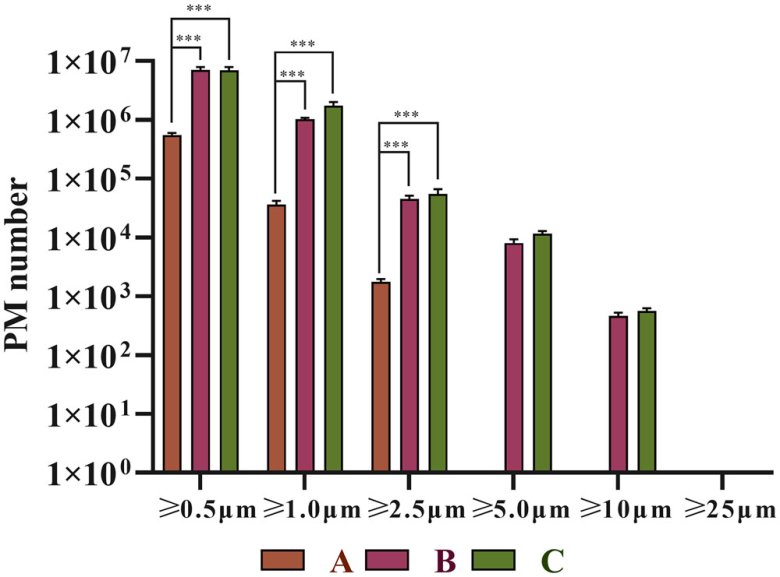
图2 三个厂家头孢唑啉钠注射液输液中不溶性微粒数比较(根据头孢唑啉钠注射液复溶后的体积(100 mL),计算出三种制剂中不同粒度的不溶性微粒数量,与相同粒度范围的制剂相比,p<0.001)。
2.不溶性微粒形态评价
测试样品的SEM结果如图3所示:制剂A的不溶性微粒形状规则,且存在少量小粒径颗粒。制剂A的颗粒呈立方体结构并且相对圆形。制剂B和C的不溶性微粒形状不规则,小粒径颗粒数量较多。颗粒形状呈纺锤形、条形、碎片形和多面体形。
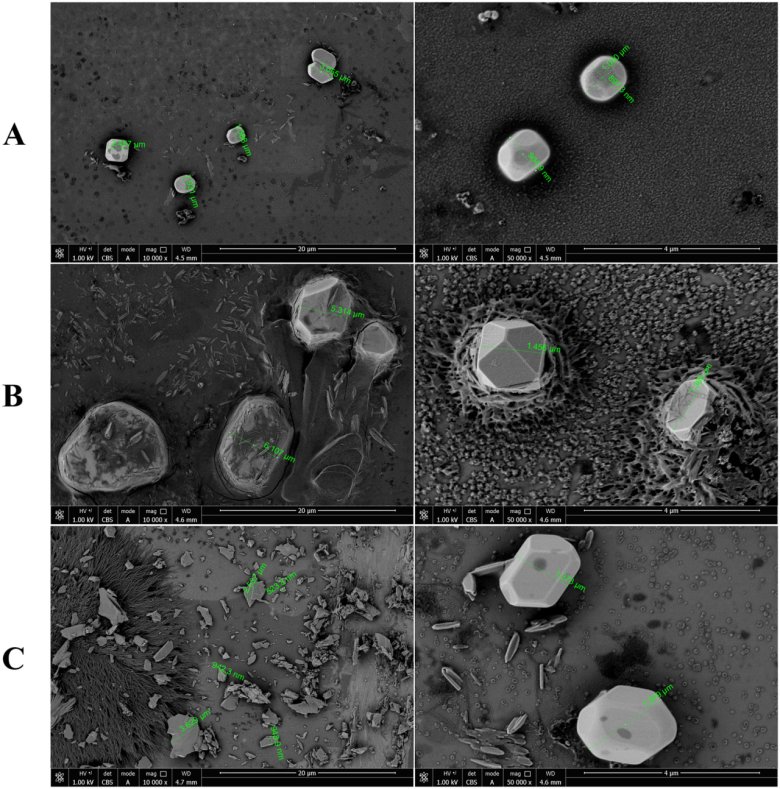
图3 不同厂家头孢唑啉钠注射液复溶后不溶性微粒的SEM图像。(A)A制剂、(B)B制剂、(C)C制剂。左侧图像的放大倍数为 10,000 倍,右侧图像的放大倍数为 50,000 倍。
3 总结
检测和控制注射产品中不溶性微粒的分布对于确保药物安全性和有效性至关重要。大量研究表明,小粒径的不溶性微粒与血栓和炎症等潜在的风险有关。因此,对于小粒径不溶性微粒的检测是评估输液产品安全性的一个重要指标。
本文研究头孢唑林钠不同包装形式对小粒径不溶性微粒分布的影响,使用了SPOS技术、传统光阻法和SEM对不溶性微粒进行评估。SPOS技术,与传统的光阻法(检测>2 μm颗粒浓度)不同,可检测到小至0.5 μm的亚可见颗粒。不同包材下复溶后产品的小粒径(0.5~2.5 μm)不溶性微粒浓度存在显著差异,其结果与SEM结果一致。
结果表明,双腔袋包装形式的小粒径不溶性微粒的数量显著低于传统的小瓶(西林瓶)制备形式。双腔袋包装形式可能是减少小粒径不溶性微粒不良反应的有效替代方案,对指导临床合理用药具有一定意义。