 白金会员
白金会员
 已认证
已认证

(以下数据由鸿蒙标准物质小编进行不完全统计)
近年来,国内外药企因可见异物被召回、罚没的事件频发。
据不完全统计,2020年至今,在中国因药品质量问题召回的产品,注射剂产品不在少数,其中召回原因中“可见异物”不符合规定出现的频次颇多,并有企业在近几年多次因可见异物多次被罚,其中某企业被罚金额高达650万。
根据我国《中华人民共和国药品管理法》第一百一十七条规定:生产、销售劣药的,没收违法生产、销售的药品和违法所得,并处违法生产、销售的药品货值金额十倍以上二十倍以下的罚款;违法生产、批发的药品货值金额不足十万元的,按十万元计算,违法零售的药品货值金额不足一万元的,按一万元计算;情节严重的,责令停产停业整顿直至吊销药品批准证明文件、药品生产许可证、药品经营许可证或者医疗机构制剂许可证。
药品面前无小事,可见异物问题不容小觑。不仅国内严格,国外亦是如此!
2023年12 月 21日,辉瑞旗下无菌注射剂部门 Hospira 宣布了两次独立的召回,原因是某些药物的小瓶和注射器中可能存在玻璃颗粒。Hsopira一年发生过多次召回事件,却并没有更进一步解决玻璃颗粒污染问题。
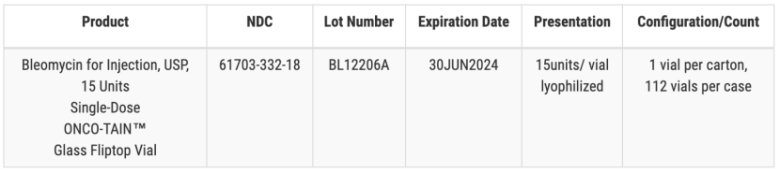
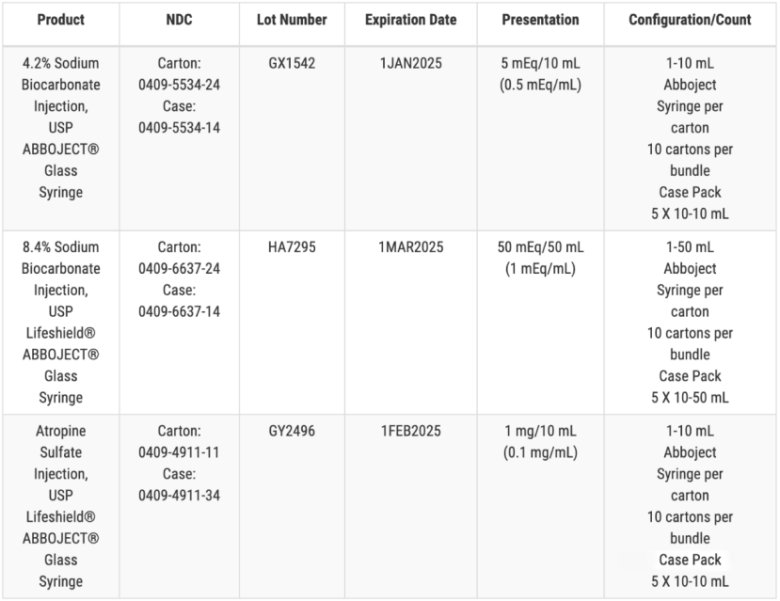
这不是 Hospira 的第一次召回事件,早在2017 年和 2018 年,Hospira 就因一批 25% 婴儿葡萄糖注射液的注射器中发现颗粒、微生物生长和人类毛发问题而多次召回注射液。而2023年 12 月底,Hospira 召回了一批 1.5g 剂量的抗生素盐酸万古霉素,原因是小瓶中有玻璃颗粒。10 月份,召回了一批有效期为 2024 年 8 月的 4.2% 的碳酸氢钠注射剂,同样是玻璃颗粒问题。Hospira 还召回了一批有效期为 2024 年 6 月的 1% 盐酸利多卡因注射剂和一批有效期为 2024 年 7 月的 2% 盐酸利多卡因注射剂。
药品中的可见异物问题会影响企业的品牌形象,降低消费者对企业的信任度,从而影响企业的销售和市场占有率。因此,药品生产企业需要采取有效措施控制可见异物的产生,确保产品质量符合要求,以避免对企业造成不良影响。
《中国药典2020版:0904可见异物检查法》中规定:可见异物系指存在于注射剂、眼用液体制剂和无菌原料药中,在规定条件下目视可以观测到的不溶性物质,其粒径或长度通常大于50μm。采用灯检法进行结果判定时,供试品中不得检出块状物、金属屑、玻璃屑、纤维、絮状物、点状物等明显的可见异物。
注射剂、眼用液体制剂应在符合药品生产质量管理规范(GMP)的条件下生产,产品在出厂前应采用适宜的方法逐一检查并同时剔除不合格产品。临用前,需在自然光下目视检查(避免阳光直射),如有可见异物,不得使用。
为什么注射液中会有可见异物存在呢?因为在注射液的生产、储存、运输、配置和使用过程中几乎都有可能被可见异物/不溶性微粒污染。通过应用可见异物标准物质,可以加强药品的检测力度,同时还可为企业建立产品追溯体系,便于确定异物的最初来源及材质,保障后续产品生产。
海岸鸿蒙作为全国唯一一家获得可见异物标准物质证书的企业,我们能够为制药行业提供更加精准、可靠的检测服务、可见异物溯源及专属可见异物解决方案,所生产的可见异物微粒标准物质完全符合《中国药典2020版:0904可见异物检查法》要求,可帮助企业深入分析可见异物来源、检测设备检定校准与相关人员培训,为我国医药行业可见异物的质量控制提供帮助,并协助建立整体的、全生命周期管理的可见异物控制策略,保障企业经营。


全国唯一一张可见异物证书
海岸鸿蒙作为深耕二十七载的标准物质研发生产企业,颗粒标准物质的研发已经达到国内领先、国际先进水平,可见异物等百余种标准物质的研制成功填补国内空白,并可提供特殊定制服务,帮助药企减少风险,保障患者安全。







