 白金会员
白金会员
 已认证
已认证
2023注射剂注册评审及一致性评价培训班于6月8日—11日在北京成功举行。此次活动通过培训方式,帮助参训学员准确掌握注射剂产业最新监管政策、审评技术等动态,并针对《中国药典》对注射剂产业高质量发展相关的质量要求和检验方法作出交流活动。
此次会议由国家药品监督管理局主办,邀请中检院首席专家胡昌勤教授、沈阳药科大学博士生导师袁红梅教授等业内知名专家学者进行授课。海岸鸿蒙窦晓亮博士在6月10日下午分享的“不溶性微粒检查光阻法的检测与校准,可见异物自动检查设备的确证方法”主题内容,受到参训人员的认可。

可见异物/不溶性微粒 医药企业的持续挑战
生物医药领域作为21世纪最具发展前景的领域之一,随着药物质量研究的深入以及患者依从性需求的提高,注射给药途径逐渐趋于主流,注射产品是当如今全球生物制药市场发展中的主要增长引擎。
目前,美国FDA批准的药物中有40%以上是可注射的皮下和肌肉注射产品,注射产品在这些批准的药物中所占的比重正越来越大。
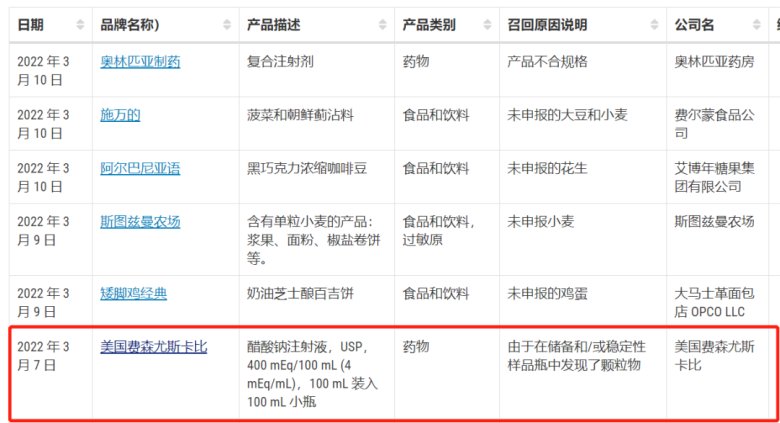
注射剂产品正经历飞速发展,但产品质量问题同样不可忽视,国内外因产品因质量问题而召回的事件频频发生,其中因颗粒异物问题被召回处于前列。如西班牙ROVI制药公司生产的COVID-19疫苗产品存在可见异物问题,美国费森尤斯卡比频繁出现产品因可见异物的因素召回产品,福建某药业生产的注射液一年内被两次检出可见异物,黑龙江某制药厂生产的葡萄糖注射液产品内有可见异物……
颗粒异物问题作为生物医药界常见且极具挑战性的问题,它直接影响生物药的安全性和有效性。一旦产品中出现不符合监管要求的异物颗粒,会导致危机患者生命安全及产品召回等后果。因此,如何避免由于异物颗粒导致的安全影响,是企业面临的持续挑战,加强药品的质量管理,则是企业永恒的责任。
海岸鸿蒙标准物质 助力药企质量管理
随着临床上注射剂的大量使用,由注射剂中不溶性微粒引起的临床不良反应案例不断发生,国内外药典等对注射剂中微粒进行了严格的控制。
《中国药典》2020年版(ChP 2020)、《美国药典》43-国家处方集 38(USP 43-NF 38)、《欧洲药典》10.0(EP 10.0)、《英国药典》2021(BP 2021)和《日本药典》18(JP 18)都对不溶性微粒和可见异物有明确规定,均采用光阻法和显微镜法进行检测。
以中国药典为例,不溶性微粒可以通过光阻法和显微计数法两种方法测量,其中光阻法的判定标准为:
(1)标示装量为100mL或100mL以上的静脉用注射液除另有规定外,每1mL中含10μm及10μm以上的微粒数不得过25粒,含25μm及25μm以上的微粒数不得过3粒。
(2)标示装量为100mL以下的静脉用注射液、静脉注射用无菌粉末、注射用浓溶液及供注射用无菌原料药除另有规定外,每个供试品容器(份)中含10μm及10μm以上的微粒数不得过6000粒,含25μm及25μm以上的微粒数不得过600粒。
除了明确的颗粒数量要求,《中国药典》中规定仪器的校准所用仪器应至少每6个月校准一次。
做好药品可见异物/不溶性微粒的风险控制,是确保药品安全性和有效性的重要措施。
海岸鸿蒙深耕标准物质领域二十七载,颗粒标准物质的研发已经达到国内领先、国际先进水平,可见异物等百余种标准物质的研制成功填补国内空白,并可提供特殊定制服务。
海岸鸿蒙更将作为生物医药企业的合作伙伴,为生产中的质量管理,减少异物颗粒提供有效保障,助力企业在不断变化的市场状况下应对新的挑战。









