 白金会员
白金会员
 已认证
已认证
利用BUCHI SFC系统
加速尿嘧啶和黄嘌呤类化合物的制备分离
尿嘧啶和黄嘌呤类物质,即咖啡因、可可碱和茶碱,是一类在各种人类生物活动过程中发挥重要作用的有机化合物。这些分子属于杂环化合物类,其特点是含有既有碳又有氮原子的环结构。尿嘧啶是 RNA 的基本组成部分,是构成遗传密码并参与蛋白质合成的核碱基之一。
另一方面,咖啡因、可可碱和茶碱这些黄嘌呤类物质,是结构相似但具有不同生物效应的生物碱。这些黄嘌呤类物质存在于各种植物来源中,是众所周知的刺激物质,能够穿过血脑屏障并影响中枢神经系统,目前成熟且广泛应用的分离方法往往是利用 RP-HPLC(反向色谱法)。
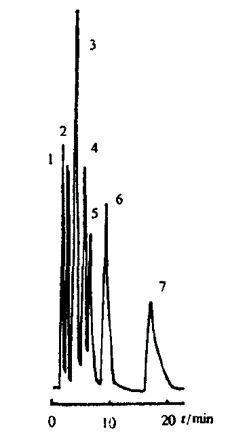
▲ 图示:利用 YWG C18(150 x 4.6mm,5μm)色谱柱,7.5% 甲醇等度,10mmol/L KH2PO4-Na2HPO4 缓冲液(pH 5.0)分离混合物,紫外检测波长 260nm。1.尿嘧啶;2.胸腺嘧啶;3.腺嘌呤;4.可可碱;5.尿嘧啶丙酸;6.茶碱;7.咖啡因[1]
关于此类应用的反向色谱法已经被优化到了极致,因此在本文中,我们想尝试以不同的方式来分离这些化合物,找出一个更快、更高效的解决方案。
SFC(超临界流体色谱)是一种色谱技术,其移动相的一个重要组成部分是超临界二氧化碳。二氧化碳处于超临界状态时具有独特的性质,如高扩散系数和低粘度,使其成为化合物分离和分析的优良溶剂。SFC 相对于传统色谱方法具有许多优势,包括更快的分析时间、更低的溶剂消耗以及在分离中的差异选择性。此外,与 RP-HPLC 相比,SFC 代表了一种正交技术,为各种分析挑战提供了互补的分离能力。
在 SFC 中,筛选色谱柱并找到最适合特定分离任务的固定相,是提高分离度的关键步骤。固定相是色谱系统的重要组成部分,因为它直接影响选择性。不同的固定相具有不同的化学功能和与样品相互作用的能力,使其对特定化合物更具选择性。通过筛选和选择合适的色谱柱,可以优化分离条件,实现目标分析物的更好分辨率和灵敏度。
本文描述了使用 Sepmatix 8x SFC 平行色谱分析系统对尿嘧啶、咖啡因、可可碱和茶碱混合物进行平行柱筛选,并随后将方法放大到制备型 Sepiatec SFC-50 仪器的过程。
设备

▲ Sepmatix 8x SFC 超高效平行色谱系统

▲ Sepiatec SFC-50 制备色谱系统
色谱柱
BUCHI PrepPure 硅胶, 5 um, 250 x 10 mm制备色谱柱
BUCHI PrepPure 二醇基, 5 um, 250 x 10 mm制备色谱柱
BUCHI PrepPure PEI, 5 um, 250 x 4.6 mm
BUCHI PrepPure CBD, 5 um, 250 x 4.6 mm
BUCHI PrepPure 硅胶, 5 um, 250 x 4.6 mm
BUCHI PrepPure 二醇基, 5 um, 250 x 4.6 mm
BUCHI PrepPure 氨基, 5 um, 250 x 4.6 mm
BUCHI PrepPure 2-EP, 5 um, 250 x 4.6 mm
Reprosil 4-EP, 5 um, 250 x 4.6 mm (Dr. Maisch GmbH)
氰基, 5 um, 250 x 4.6 mm, (Dr. Maisch GmbH)
1 试剂与样品
食品级二氧化碳(99.9%)
甲醇(≥ 99%)
尿嘧啶(99+%)
可可碱(99%)
咖啡因(99+%)
茶碱(99%)
样品准备:在 50/2.5mL 甲醇/水中,溶入50mg 尿嘧啶,70mg 咖啡因,55mg 可可碱和85mg 茶碱,需加热至 40℃,并配合超声波辅助溶解。
2 实验部分
1、利用 Sepmatix 8x SFC 筛选色谱柱
筛选结果:
使用 Sepmatix 8x SFC 平行色谱仪器可以高效地同时筛选 8 根柱。因此,可以在很短的时间内确定最佳选择性。为此,使用了8种不同的固定相:硅胶、氨基、氰基、二醇基、2-EP、4-EP、PEI 和 CBD(型号请见上文),具体表现请看下图。
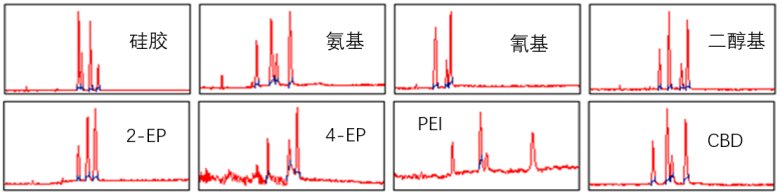
▲ 图示:8根不同固定相的色谱柱在分离尿嘧啶,咖啡因,可可碱和茶碱混合物时的表现。
结果显示除了氰基、2-EP 和 4-EP 相外,所有其他固定相都可以分离样品,因此我们需要分析最佳分离度的固定相。此时,分辨率(R)可以量化分析物之间的分离程度。
在处理复杂混合物时,R 值尤为重要,因为它确保每种分析物都能被很好地分离并准确识别和定量。R 为 1 表示峰根本没有分离,实质上是合并的,而更高的R值表示峰之间的分离更好。在实践中,R 至少为 1.5 通常被认为是适合进行正确定量和鉴定分析物的。
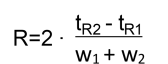
tR2 和 tR1 =组分 1 或组分 2 的保留时间
W1 和W2 =组分 1 或组分 2 的峰高的一半处的宽度
我们将不同固定相的R值计算并列入下表进行对比:
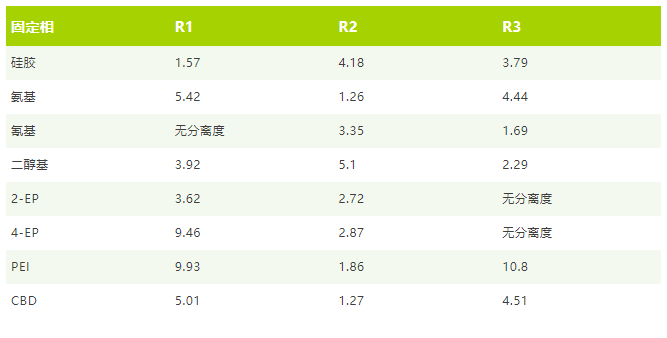
筛选和 R 值的评估显示,硅胶、二醇基和 PEI 相具有最佳的选择性来分离样品,我们需要结合分离图谱来筛选合适的固定相。在硅胶柱上,第一个与第二个峰并未呈现完全的基线分离。使用 PEI 相时,由于样品分子的较高滞留性,运行时间相对较长。而二醇基无论在分离度和时间上都有出色的表现,因此我们最终选择二醇基作为制备分离时的固定相,色谱柱为 BUCHI PrepPure 二醇基, 5 um, 250 x 10 mm 制备色谱柱。
2、使用 Sepiatec SFC-50 制备分离样品
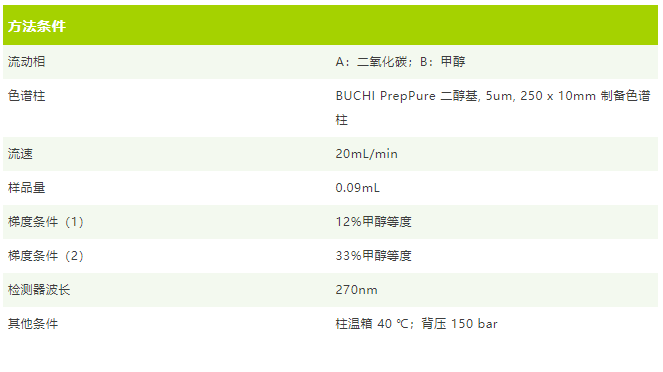
在 SFC 上,我们可以通过堆叠进样的形式来制备纯化,其生产率明显高于通过多次进样进行的梯度纯化。由于堆叠进样只能在等度条件下进行,因此需要先摸索不同等度比例下样品分离效果。
实验结果:

▲ 图示:33% 等度甲醇,4min 条件下,尿嘧啶,咖啡因,可可碱和茶碱混合物的分离效果
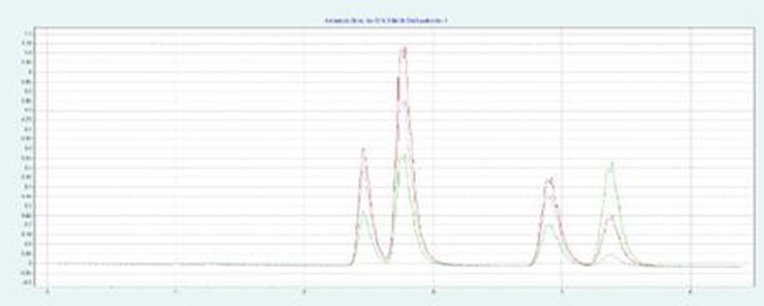
▲ 图示:12% 等度甲醇,5min 条件下,尿嘧啶,咖啡因,可可碱和茶碱混合物的分离效果
由上图可得知,33% 的甲醇条件下,尿嘧啶,咖啡因,可可碱和茶碱无法被完全分离,而 12% 的甲醇条件下,样品分离度非常好。以此为基础,我们进一步去开发叠层进样的方法。
通过 Sepiatec SFC 的智能叠层进样时间推荐,我们把叠层进样的时间设置为 2.42 分钟,既每 2.42 分钟一次注入一次样品,总计 8 次,上样量增加到 0.12mL。
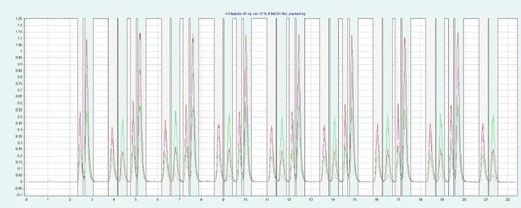
▲ 图示:通过 2.42min 间隔的叠层进样在短时间内进行8次制备分离
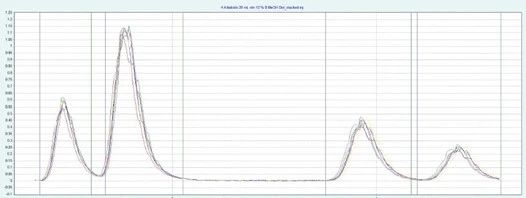
▲ 图示:多次进样的叠加图片
每次进样的相应叠加 UV 信号表明该方法具有良好的重现性,垂直线描述了收集相应份数的时间窗口。
硅胶色谱柱的分离:
为了与二醇基填料进行对比,我们也尝试使用硅胶填料进行叠层进样与分离,其参数如下:
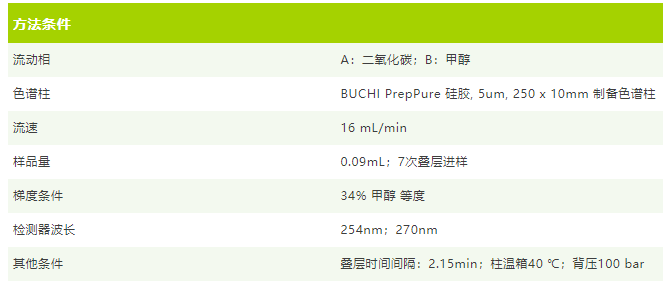
实验结果:
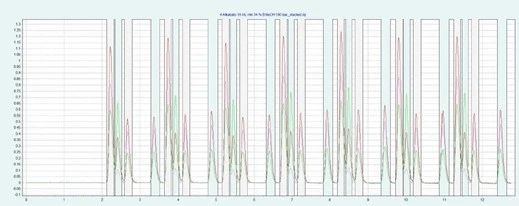
▲ 图示:通过 2.15 min 间隔的叠层进样在短时间内进行 7 次制备分离
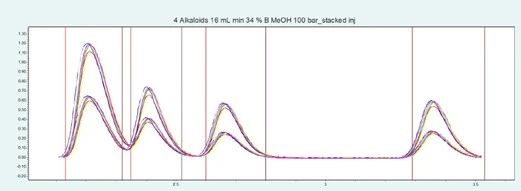
▲ 图示:多次进样的叠加图片
与二醇基相比,硅胶在 100bar 下表现更好,时间也更短。但是,在 R=1.57 的分辨率下,第一与第二个峰并不能理想地基线分离,会造成部分样品损失。
2 结论
在这个应用中,使用 Sepmatix 8x SFC 平行色谱仪器进行了柱筛选,并将最佳色谱柱放大到 Sepiatec SFC-50 仪器。在色谱参数分辨率和运行时间方面,二醇基显示出最佳结果。作为对比,还开发了一种用于硅胶柱的方法,但分辨率值略低。这表明,如果需要用 SFC 制备并获取大量化合物,通过柱筛选事先确定最佳色谱条件是很重要的。之后,该方法可以简单地放大至制备级 SFC 上,并最终进行优化,配合叠层进样,获取大量样品。3 参考
1.韩金土, 乐良. 生物碱基及其衍生物的反相离子对色谱行为研究. 信阳师范学院学报(自然科学版)第12卷,第2期,1999年4月







