 白金会员
白金会员
 已认证
已认证
12 月 21日,辉瑞旗下无菌注射剂部门 Hospira 宣布了两次独立的召回,原因是某些药物的小瓶和注射器中可能存在玻璃颗粒。Hsopira一年发生过多次召回事件,却并没有更进一步解决玻璃颗粒污染问题。
Hospira 在 FDA 网站上发布的一份通知中表示,就注射抗癌药博莱霉素而言(一个批次,15 个单位的产品),一份经确认的客户报告提醒 Hospira 注意单个小瓶中存在玻璃颗粒。
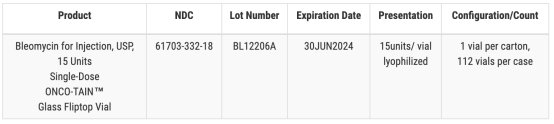
另一召回涉及三种药物,包括两种规格的注射用碳酸氢钠,以及一批硫酸阿托品注射剂。在 Hospira 的例行产品检查中标记为“可能存在玻璃颗粒物质”。辉瑞和 Hospira 均表示,截至 12 月 21 日,他们尚未收到任何副作用或安全性报告。
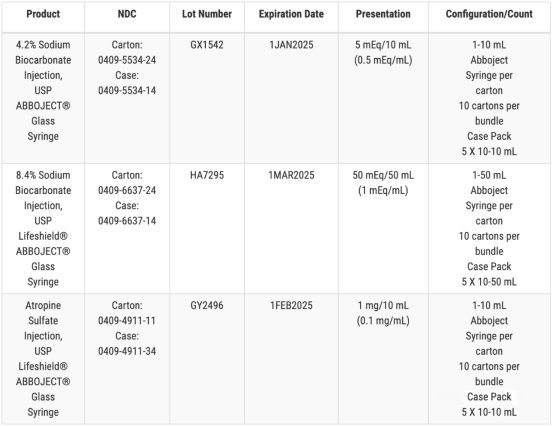
可见颗粒污染可能会产生严重的安全后果,关乎病人的生命安全。Hospira 警告指出,如果患者接受了被玻璃污染的药物,可能会发生“严重不良事件”。潜在的并发症可能包括静脉炎症和肉芽肿的形成,或因感染和炎症、刺激物或异物反应而出现的微小白细胞和组织簇。Hospira 还警告指出,注射含有玻璃颗粒的药物也可能会阻塞血管并导致危及生命的凝血事件。
这不是 Hospira 的第一次召回事件,去年 12 月底,Hospira 召回了一批 1.5g 剂量的抗生素盐酸万古霉素,原因是小瓶中有玻璃颗粒。10 月份,召回了一批有效期为 2024 年 8 月的 4.2% 的碳酸氢钠注射剂,同样是玻璃颗粒问题。Hospira 还召回了一批有效期为 2024 年 6 月的 1% 盐酸利多卡因注射剂和一批有效期为 2024 年 7 月的 2% 盐酸利多卡因注射剂。
辉瑞于 2015 年以 170 亿美元收购的 Hospira 一直召回不断。早在2017 年和 2018 年,Hospira 就因一批 25% 婴儿葡萄糖注射液的注射器中发现颗粒、微生物生长和人类毛发问题而多次召回注射液。
为什么注射液中会有这么多颗粒呢?因为在注射液的生产、储存、运输、配置和使用过程中几乎都有可能被不溶性微粒污染。做好药品可见异物/不溶性微粒的风险控制,是确保药品安全性和有效性的重要措施。
《中国药典2020版:0904可见异物检查法》中规定:采用灯检法进行结果判定时,供试品中不得检出块状物、金属屑、玻璃屑、纤维、絮状物、点状物等明显的可见异物。
为此,海岸鸿蒙研制出了对应材质的可见异物微粒标准物质,可增强生产中的质量管理,溯源可见异物来源,制定可见异物解决方案,助力企业的自我挑战。
海岸鸿蒙作为深耕二十七载的标准物质研发生产企业,颗粒标准物质的研发已经达到国内领先、国际先进水平,可见异物等百余种标准物质的研制成功填补国内空白,并可提供特殊定制服务。








