 白金会员
白金会员
 已认证
已认证

概要
有效的颗粒监测策略对于安全生物制剂的开发和生产至关重要,因为这些颗粒可以极大地影响患者的治 疗结果。 流式成像显微镜(FIM)是一种备受关注的技术,用于确定生物治 疗样品中直径2 - 100 μm的亚可见颗粒的数量、大小和类型。
FlowCam Nano将这种分析扩展到更小的亚可见和亚微米颗粒(直径为300 nm - 2 μm的颗粒),这是传统的FIM仪器无法有效成像的粒度范围。 亚微米FIM允许用户检测颗粒源,如API聚集和细菌污染,最初产生的颗粒太小,无法通过传统成像技术检测,但如果不解决,可能会聚集成更大的亚可见颗粒。
在本研究中,我们通过使用传统的亚可见和亚微米FIM分析含有蛋白质聚集体、蔗糖聚集体和大肠杆菌细胞的溶液,展示了FlowCam Nano在生物治 疗开发中的应用。 对于每种样品类型,FlowCam Nano提供了颗粒大小和形状信息。
在一项同时进行的研究中,两台FlowCamNano也被用来证明其准确检测细菌相对颗粒浓度的能力。 这些研究表明,FlowCam Nano可以可靠地检测聚集的颗粒源和细菌污染,而且可能比传统的FIM应用于更早期的检测。
介绍
所有生物制剂都含有颗粒。 颗粒可以有各种来源,如活性药物成分(API)及其聚集物,容器封闭系统(如硅油滴,玻璃碎屑),上游处理步骤的污染物,以及其他来源。 虽然这些微粒可以是蛋白药物的活性成分(例如,细胞药物产品中的细胞,药物输送载体),但它们通常是杂质,可能会显著降低治 疗药物的疗 效。 建议研究人员在其生物治 疗药物中对颗粒进行特征描述,不仅要满足诸如USP <788>等法规,而且要确定和控制颗粒形成的来源,并最 大限度地提高其治 疗的安全性和有效性。 因此,新的、更灵敏的技术对于确保这些治 疗的安全性至关重要。
流动成像显微镜(FIM)是一种日益流行的技术,用于分析生物治 疗中的微粒。 像FlowCam这样的FIM仪器结合了微流体和光学显微镜技术,可以快速、大量地自动捕捉图像。 这些图像可以用来分析生物治 疗样品中颗粒的浓度、大小分布和形态。 然后,用户可以将这些信息与正交技术的信息一起分析,从而对样本质量进行有用的全面评估。
典型的FIM仪器被设计用于分析直径大于2 μm的亚可见颗粒(见图1和表1)。这些亚可见颗粒受到了研究人员的广泛关注,然而人们对分析生物制药中传统成像技术尺寸范围之外的更小的亚微米颗粒(即100 nm到1 μm之间的颗粒)越来越感兴趣。 虽然这些颗粒不直接受USP <787/788>等规则的约束,但在这个尺寸范围内的颗粒可以聚集或以其他方式促进更大的亚可见颗粒的形成,因而会相关颗相关粒法规规则的监管。 像FIM这样用于分析这些亚微米颗粒的技术将使得用户能够在进一步团聚发生之前及早检测颗粒产生的来源,如蛋白质和蔗糖的聚集。 此外,一些颗粒的尺寸分布较窄,接近或低于典型FIM仪器的尺寸范围(如细菌细胞、一些药物传递载体),需要亚微米聚焦方法才能被检测。
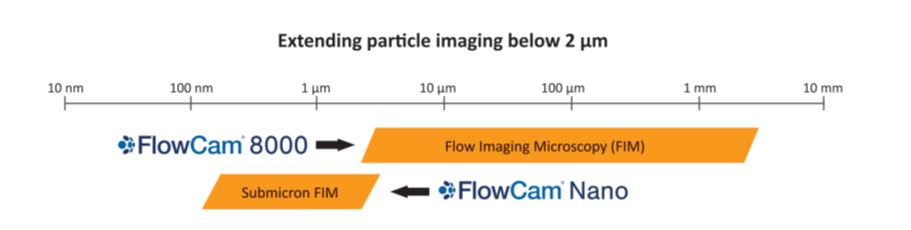
图1:FlowCam Nano和FlowCam 8000系列仪器的尺寸范围
FlowCam Nano是近年来引入的一种用于检测和分析亚微米颗粒的新型颗粒分析技术。 该仪器采用了FIM的 专 利改造,采用了基于油浸的光学显微镜系统,使用40倍物镜来捕获颗粒图像(图2)。这使得该仪器能够检测到300 nm到2 μm之间的颗粒,这是光学显微镜可见的最小物体。 在这个尺寸范围内的颗粒不仅被传统的流动成像显微镜所忽略,而且用其他的颗粒分析仪器也很难对其进行表征,其中许多仪器要么不是集成技术,要么不提供形态信息。 像传统的FIM仪器一样,FlowCam Nano记录每个颗粒的大小和形态信息,这些信息可以用于识别样品中亚微米颗粒的类型。
该仪器使用的浅景深设计是为了最 大限度地提高图像质量,从而从仪器中获得形态信息。 虽然这种景深导致一些物体不对焦,从而无法检测到,但仪器报告的相对颗粒计数样品之间是一致的,使得FlowCam Nano也能够用于监测相对颗粒水平。 该设备还可以在校准计数模式下操作,为包含深色、易于检测的物体的样品提供精确的颗粒计数,类似于聚苯乙烯乳胶校准珠。FlowCam Nano还保留了典型FIM仪器的高通量和易于使用的优点,允许快速和高效的颗粒成像,特别是相对于手动油浸显微镜。
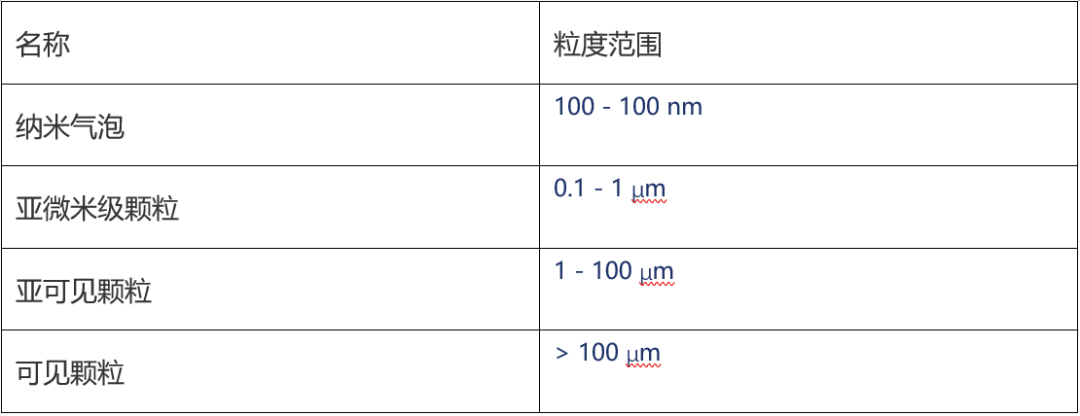
表1:不同颗粒尺寸的通用定义。FlowCam 8100和其他FIM仪器专注于亚可见颗粒,FlowCam Nano专注于亚微米颗粒。
为了证明FlowCam Nano在生物治 疗开发中的应用,本研究比较了FlowCam 8100检测到的亚可见颗粒和FlowCam Nano检测到的亚微米颗粒的大小分布和图像。 在两种仪器上分析了治 疗蛋白配方中三种潜在的杂质:蛋白质聚集体、蔗糖聚集体和污染细菌。 我们还使用FlowCam Nano来测量不同稀释度下的细菌培养浓度,以评估仪器的计数性能。
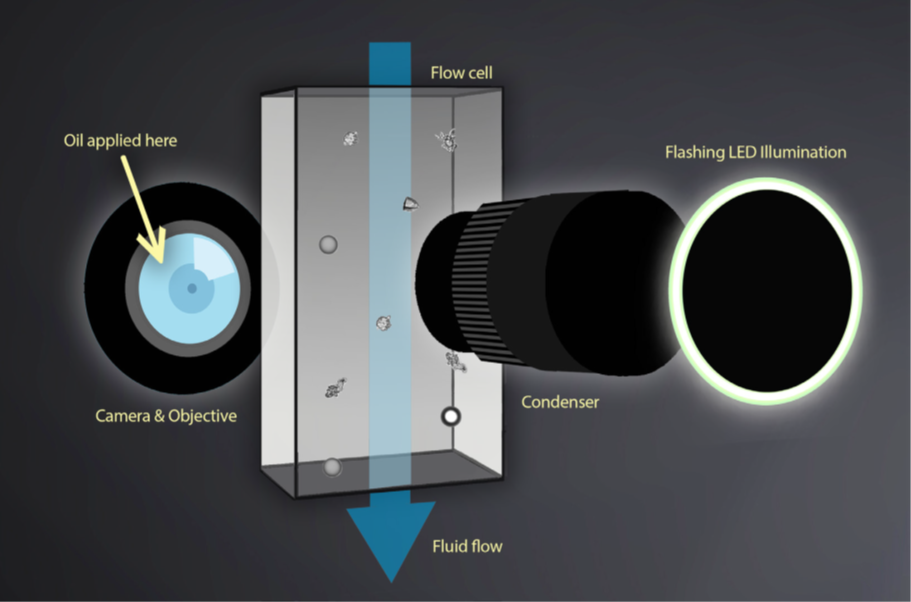
图2:油浸式流动成像显微镜示意图,FlowCam Nano使用该技术对亚微米颗粒进行成像
实验与方法
材料:牛血清白蛋白(BSA)粉末、蔗糖和磷酸盐缓冲盐水(PBS)取自Sigma-Aldrich公司(圣路易斯,MO)。 大肠杆菌培养物来自Carolina Biological Supply (Burlington, NC)。 分别用700 nm和15 μm Duke Standards聚苯乙烯微球聚焦FlowCam Nano和FlowCam 8100。FlowCam Nano的浸泡油来自ibidi(菲希堡,WI)。Micro-90来自International Products Corp. (Burlington, NJ)。
样品制备:将含有蛋白质聚集物、蔗糖颗粒和大肠杆菌细胞的样品置于PBS中进行FIM分析。 制备15ml 1mg / mL BSA PBS溶液,涡流产生蛋白聚集物。 为了生成蔗糖颗粒,将含有5% w/v蔗糖的25ml PBS加热至37°C恒定搅拌2小时,然后在室温下孵育过夜。 将大肠杆菌培养物用PBS连续稀释,获得含有不同浓度细菌细胞的样品。 从卡罗莱纳生物公司获得的大肠杆菌培养物用PBS稀释为1:100,生成含有适当浓度的用于FIM分析的样品。 然后将这种“储备”溶液稀释到1:2、1:4、1:8和1:16,以得到含有不同浓度细菌的样品。
流动成像显微镜(FIM):FlowCam 8100和FlowCam Nano (Yokogawa Fluid Imaging Technologies; Scarborough, ME)用于分析前一节中描述的样品的颗粒含量。 使用VisualSpreadsheet®5.8软件对两个FlowCam模型的所有实验进行仪器操作和数据分析。 两种仪器都使用内置的自动对焦软件对聚苯乙烯乳胶校准珠进行了聚焦。FlowCam 8100单元使用15 μm微珠进行聚焦,而FlowCam纳米单元使用700 nm微珠进行聚焦。 每个仪器中的流体在测量前用1%的Micro-90溶液清洗,然后在样品之间用PBS清洗。
FlowCam 8100配备了10X物镜、FOV80流单元和单色相机。 以150 μL/min的流速分析1ml样品。 颗粒检测采用15个暗像素和15个亮像素阈值,4次闭孔迭代,距离最近邻4 μm进行分割。 本次分析使用的成像对象为直径2-10 μm的物体。
FlowCam Nano配备了40X物镜、60 μm流量单元和灰度相机。250 μL样品在25 μL/min流速下进行分析。 每个样品采用相对计数方式进行分析。 蛋白质聚集体和蔗糖颗粒样品采用20个暗像素和18个光像素阈值,3次闭孔迭代,距离最近邻0.1 μm。 考虑到其更透明的颗粒,大肠杆菌样品采用12光像素阈值、4个封闭孔迭代和1 μm距离进行分割。 每个样本类型还使用25的边缘梯度滤波器来去除失焦或其他模糊的图像。 在仪器尺寸范围内的所有其他检测到的物体都用于此分析。
使用FlowCam Nano和FlowCam 8100对蛋白质聚集体、蔗糖颗粒和大肠杆菌标本进行分析,以比较检测到的颗粒和两种仪器报告的大小分布。 在每个仪器上对每个样品进行三个等分成像。 当在一个单一的FlowCam模型上分析时,从每个样本类型收集到的所有图像被汇集在一起,用于估计颗粒大小分布,并为该样本选择图像。
对含稀释液大肠杆菌溶液的样品进行了分析,以评估所检测出颗粒浓度与样品溶液实际浓度的比例是线性的。为了评估由于仪器和操作员导致的误差,在前一节中列出的稀释剂的大肠杆菌样本被两组不同的分析人员分析。对每一组和每一组的细菌细胞浓度进行检测,实验时加载400μL样本进行了测试,并分析了其中的300μL。然后通过线性回归对产生的稀释-颗粒浓度数据进行了线性回归的分析。
结果与讨论
FlowCam Nano和FlowCam 8100比较
在传统的FIM仪器(FlowCam 8100)和流式纳米仪器上分析了蛋白质的聚集、蔗糖颗粒和大肠杆菌细胞。图3显示了每一个FlowCam 8100和FlowCam Nano的每一个样品的平均粒径分布。每一个样本都有类似的粒径分布(图3,右柱);在一个特定的大小范围内,颗粒的浓度随着颗粒粒度的减小而增加,在每个样本中检测到的物体的大部分都是存在于小粒径范围内。这种不对称的尺寸分布表明,每个样本中包含了许多额外的微粒, 并且对于小于2μm 的颗粒,FlowCam 8100已经接近检测极限。用FlowCam Nano测量的三个样本之间大小分布(图3,左)。对于蛋白质聚合体(图3、上行)和sucrose(图3、中行)样本,FlowCam Nano展现的大小分布与FlowCam 8100具有相同的趋势:这表明样品中小颗粒占比更高。
对于这些样本, FlowCam Nano检测到样本的整体颗粒含量比典型的FIM仪器相对较大。根据这种表现,FlowCam Nano可以在它们产生早期时检测蛋白质聚集,以研究降解路径,然后再通过FlowCam 8100产生可以检测到的可见颗粒。
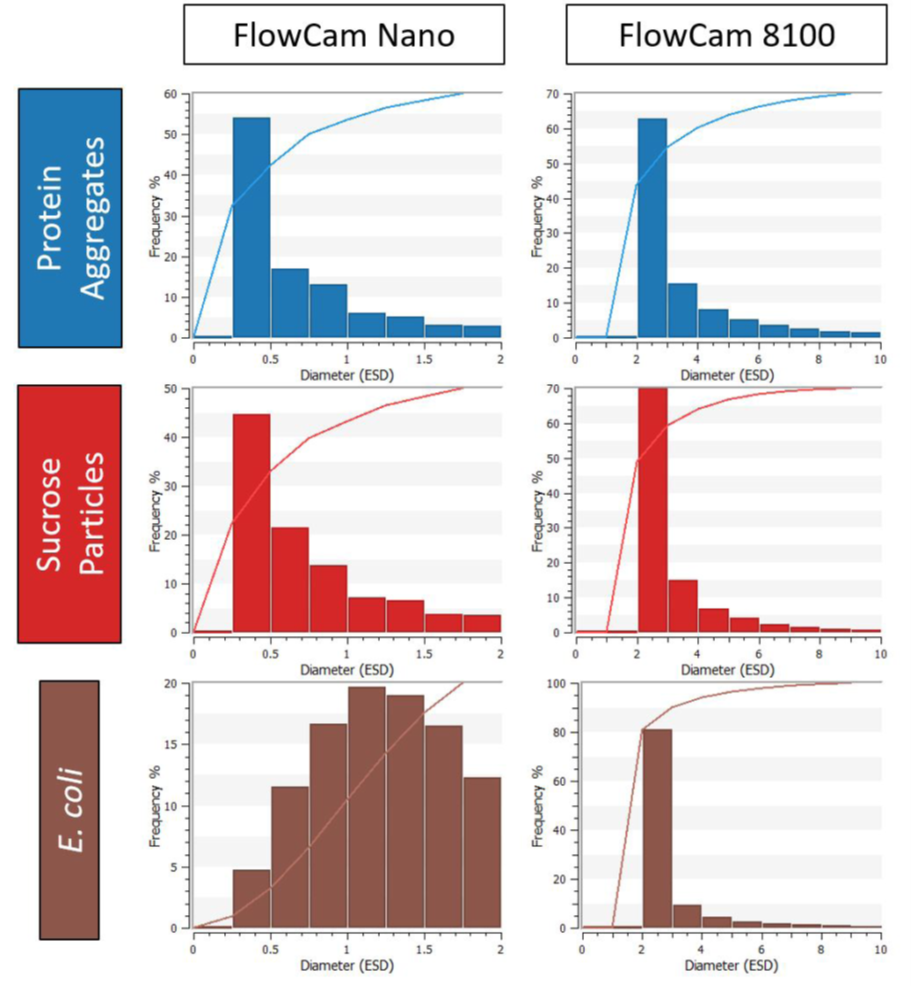
图3:含有蛋白质聚合体(顶部排)、蔗糖颗粒(中行)和大肠杆菌细胞(底部排)的样本的粒径分布。使用FlowCam Nano(左)和FlowCam 8100(右)获得尺寸分布。条形图表明,在相应的大小箱中,每一种仪器捕获的颗粒的分数。相应的线图指示
与其他样本不同的是,大肠杆菌(图3,底部排)显示了一个大小分布,峰值在1到1.25μm之间,大约是单个大肠杆菌细胞的大小。随着对颗粒被进一步确认,这些细胞的边界比分布(图4)显示了0.2和0.3之间的峰值,与有机体的边界比为0.25 (0.5 m厚,2个n长)相一致。尺寸分布表明,在这个样本中, 是FlowCam Nano检测到了大肠杆菌细胞的比例。
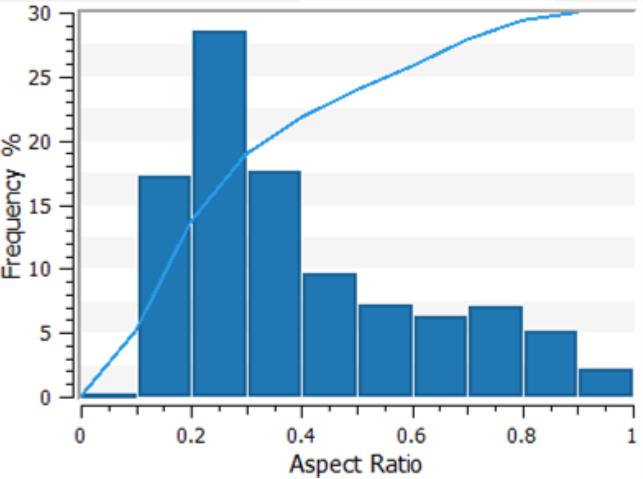
图4:通过FlowCam Nano测量的大肠杆菌细胞的颗粒孔比。这个图的格式与图2中的大小分布相匹配。
图5显示了两种仪器的三种颗粒类型的样本图像。FlowCam 8100所检测到的小颗粒通常表现出低细节图像,这使得区分不同的形态是具有一定困难。相比之下,FlowCam Nano提供了这些小颗粒更详细的图像。这些图像能够使用户很容易地将大肠杆菌的图像与其他颗粒类型区分开来,也可以帮助用户区分蛋白质聚集和蔗糖颗粒。虽然细菌污染的生物样本很难使用典型的FIM图像来检测,但由于细菌图像和更常见的蛋白制剂中颗粒物图像的鲜明对比,可以很简单地对这两类颗粒进行区分。
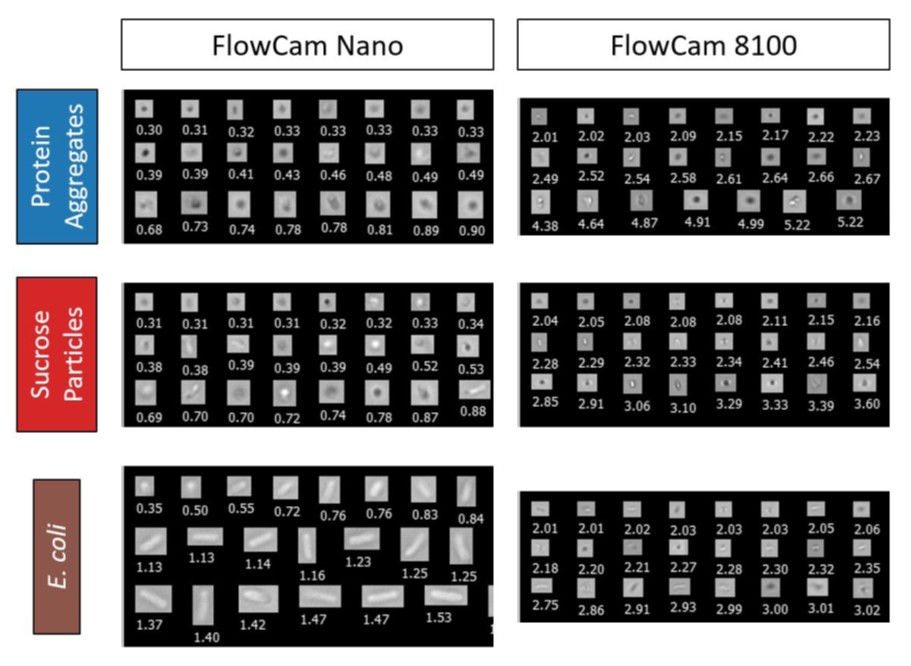
图5:FlowCam Nano(左列)和FlowCam 8100(右柱)蛋白质聚集(顶部排)、蔗糖颗粒(中行)和大肠杆菌细胞(底部排)的图像。图像与其他图像的图像近似。每一个颗粒的等效球面直径值(μm)显示在它们的图像下面。
FlowCam Nano颗粒浓度一致性
在两台FlowCam Nano仪器上对稀释的大肠杆菌样本进行了额外的实验,以评估报告颗粒浓度的相对精度。图6显示了上述两个组在不同稀释的大肠杆菌溶液中所报告的颗粒浓度。虽然两种仪器的绝 对浓度之间存在一些差异,但两种仪器在样本稀释量和观察到的颗粒浓度之间表现出很大的线性度,正如从线性回归中获得的高R2值所表明的。这些结果表明, FlowCam Nano能获得一致的颗粒浓度,可以用来监测样品中亚微米颗粒的相对数量,以及它们的大小和形状。
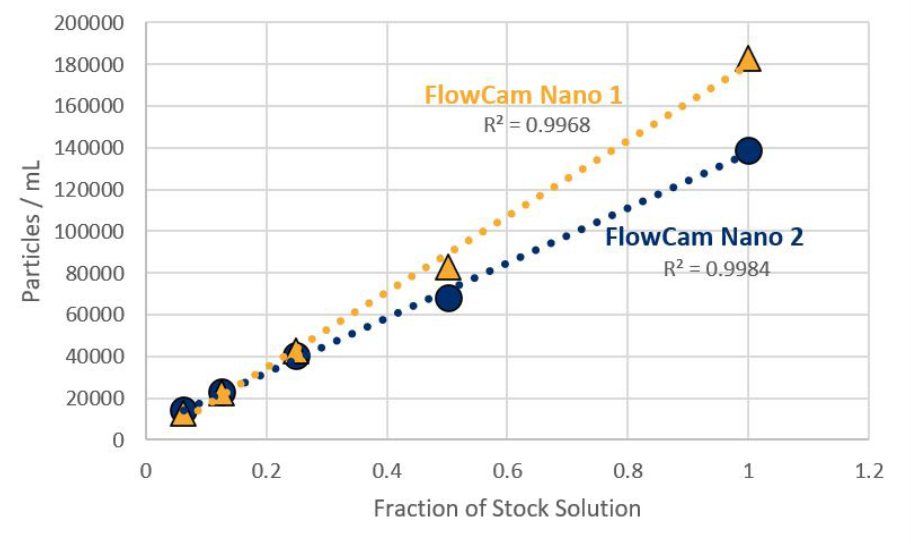
图6:对大肠杆菌样本不同稀释的颗粒浓度。每个圆圈和三角形都代表一个单一的FlowCam Nano的测量。线条代表了相应仪器的浓度数据的线性匹配。每个趋势线的R2值显示在每条线上。
结论
FlowCam Nano是一种极具价值的亚微米颗粒分析工具,捕捉颗粒,分析大小和类型信息,扩展了传统的FIM的典型测量范围。此外, FlowCam Nano提供了与样品颗粒含量一致的颗粒浓度。这些信息在分析蔗糖、细菌细胞和某些药物输送车辆等颗粒物的性能方面是无价的,通常在传统的FIM的大小范围内。在这些较小的物体上的信息也可能是有价值的,即使是在被发现的颗粒类型中,通常遇到的颗粒类型,如蛋白质聚集,在一定程度上是由较小的颗粒聚集而形成的。分析这些小的亚微米蛋白聚集物可以帮助用户识别这些物体,然后才能聚集和形成更大的颗粒。
采用FlowCam Nano的亚微米颗粒特性补充了其他分析技术。FlowCam Nano为用户提供了从其他仪器中无法获得的颗粒形态信息,这些信息可以用来确定样本中的亚微米颗粒的类型。细菌细胞和更常见的生物反应颗粒和污染物。FlowCam Nano也可以用来扩展从FlowCam 8100和其他典型的FIM仪器提供的颗粒计数和大小分布,这能够获得比任何一种单一仪器更大的检测范围。这种结合的信息可以帮助用户更好地了解他们的生物制药样本中的颗粒含量,从而对产品质量做出更快、更准确的决定。


欢迎联系大昌华嘉科学仪器部:
400 821 0778
ins.cn@dksh.com




