 钻石会员
钻石会员
 已认证
已认证
本文隶属于一体化解决方案系列,全文共 4625字,阅读大约需要 16分钟
摘要:
为了避免可能对患者造成负面健康的后果,应尽量减少任何医疗设备带来的颗粒污染。有害颗粒所带来的健康风险取决于设备以及它们进入体内的最终位置。进入静脉系统的颗粒可能会引起静脉炎、肺肉芽肿、局部组织梗塞和栓塞等,进而对人体造成伤害。有些医疗器械实际上可能不会与血液接触,而最终可能会出现在身体的任何地方。在这种情况下,医疗风险取决于器械的放置位置以及颗粒的物理/化学性质。非血管植入器械的一个主要问题是异物反应,这是一种可能导致纤维化、炎症以及装置排斥的免疫反应。考虑到这些风险,医疗器械制造商应当监控并最大程度地减少颗粒污染。
关键词:医疗器械;颗粒污染;AccuSizer 液体颗粒计数器; USP<788>
一、标准
许多标准、指导文件以及信息报告为测试医疗器械上和来自医疗器械的颗粒污染提供了建议和要求。这些文件涵盖了从广泛的指导到非常具体的测试要求以及通过/未通过标准。
AAMI TIR 42为测试、识别和制定血管器械颗粒污染限值的分析方法提供了指导。液体颗粒计数器和对过滤器上捕获的颗粒进行显微分析被认为是潜在的测试技术,但没有就最大允许颗粒计数的结论给出具体建议。相反,它建议制造商应根据颗粒的性质和器械的临床应用设定自己的限值。本文件确实参考了FDA测试支架和相关输送系统的指导文件以及USP <788>中关于设置颗粒污染限值的建议。
用于自体输血装置的ANSI/AAMI标准AT6描述了一种用低颗粒水填充装置的方法。将水收集在膜过滤器上,对纤维的微观颗粒以及所有尺寸大于10μm的颗粒进行计数。
ISO标准8536-4: 2010描述了一次性重力输液器和静脉注射器械的测试过程和验收标准。基本测试过程是让干净的水流过10个器械,直到真空过滤器收集到500mL的水。然后对过滤器进行颗粒计数并记录图1所示尺寸范围内的计数。
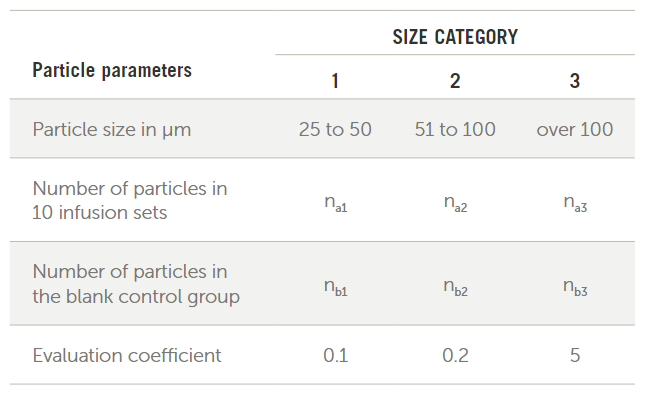
图1. 出自ISO 8536
要计算零件是否通过,请将每个尺寸类别中的计数减去空白计数乘以评估系数。将这些值相加,除以10,结果必须小于90。标准中给出的方程为:
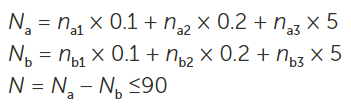
针对起搏器等有源植入式医疗器械的EN 45502和ISO 14708标准包括一项测试,以帮助确保没有不可接受的颗粒物释放。这里描述的测试包含将设备浸入装有清洁液体的容器中,该液体的体积是设备表面积的五倍。将容器在37℃的温度下搅拌8–18小时。将具有相同液体和应力条件但没有浸入式装置的参考容器用作对照组。两个容器中的液体均使用液体颗粒计数器进行测试,设备计数减去参考容器计数必须低于图2所示的浓度水平才能通过测试。
图2. 出自ISO 14708-3
ASTM标准2394为构建测试台提供了指导框架,以模拟中等难度的扭曲程度
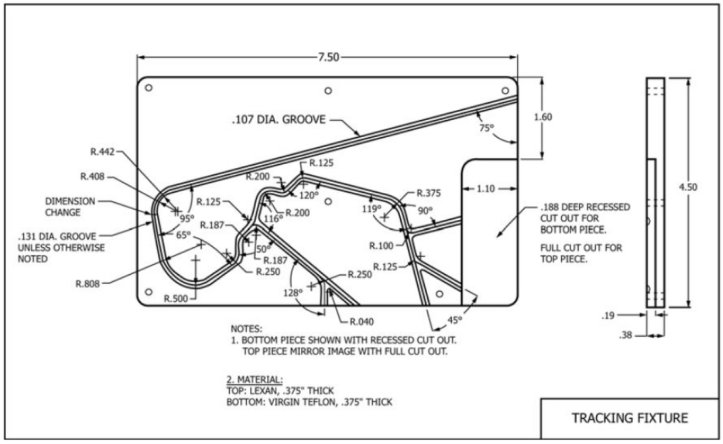
图3. ASTM 2394的测试跟踪固定装置
若干已发布和起草的 FDA 指导文件为使用曲径测试夹具测试支架时流出液体的显微检测提供了不具约束力的尺寸范围建议。
此测试的典型程序包括以下步骤:
1) 构建如图3所示的曲折路径设备
2) 将鞘管放入板的凹槽中
3) 将测试导管穿过护套
4) 将支架引导至导管中
5) 将设备扩展到最大压力或标记直径
6) 通过设备泵送清洁水
7) 将废液留存在过滤器上
8) 对已获取的颗粒进行显微镜计数
获取到的颗粒应出三个尺寸范围的报告:≥10 μm、≥25 μm,以及验证测试产生>75%回收率的最大尺寸。最大尺寸的下限应>50 μm。在采样过程中必须将颗粒混合/悬浮。验证测试涉及将已知颗粒尺寸和计数的悬浮液引入测试台和设备中。已知浓度的样品通过设备后,对流出物进行另一次颗粒计数测试。流出物中的颗粒应非常接近初始浓度。在≥10和≥25μm的条件下回收率必须>90%,系统才能被视为通过验证。还要确定回收率> 75%时的尺寸上限,以确定报告结果的第三个尺寸范围。
虽然ASTM 2394和FDA指导文件的组合提供了构建曲折路径测试台和要分析的尺寸范围的详细信息,但没有给出可接受的颗粒计数水平的建议。器械制造商负责界定合理的界限范围。
到目前为止,本文档中所讨论的任何已被认可的标准或指南都不适用于许多医疗器械。在这种情况下,通常会参考美国药典 <788> 关于亚可见颗粒的检测方法,以便在使用清水冲洗设备后对清洁度进行量化。在冲洗设备之后,会使用诸如英特格(Entegris)公司的 AccuSizer SIS系统之类的液体颗粒计数器来对去除的颗粒进行分析,如图4

图4. AccuSizer SIS 液体粒子计数
当按照;的操作流程,需对5mL的样品进行四次测量。第一次测量结果将被舍弃,然后对第二次至第四次的测量结果取平均值。针对大容量注射剂(LVI)所规定的允许浓度限值为:
25/mL ≥10μm
3/mL ≥25μm
使用美国药典<788>中关于大容量注射剂(LVI)的限值时,通过/不通过的判定标准是基于每毫升的颗粒浓度。另一种方法是计算每个器械中的颗粒数量,然后采用美国药典< 788 >中小容量注射剂(SVI)的标准,即:
6000 particle per device ≥10μm
600 particles per device ≥25μm
该程序用于测试应特格(Entegris)Aramus™一次性袋子12。在此过程中,将这些袋子装满清洁水,放置在三维摇床上,并搅拌设定的时长。所采用的程序如下:
1) 将袋子连接到测试系统管道
2) 用经过0.45μm过滤器过滤的超纯水冲洗工艺管线,绕过一次性袋子(进行冲洗操作)
3) 将超纯水通过0.45μm过滤器泵入一次性袋中
4) 使用3D摇杆搅拌袋子两分钟
5) 从废水流中抽取两个50 mL样品进行USP<788>测试
6) 对下一个样品重复上述步骤
同样的程序可以应用于多种医疗器械。可以通过这个测试确定清除产品表面颗粒的最优方法,以应用于其他器械。这方式可以是使冲洗液流经器械,亦或是将器械置于清水中并施加能量,从而让所有颗粒污染物释放出。
二、实验:输液器
使用Entegris的AccuSizer SIS液体颗粒计数器而非ISO 8536中描述的显微镜测定法,对一次性输液器进行了研究。AccuSizer SIS计数器的动态范围为0.5–400μm。该仪器通常用于各种USP测试,包括USP <787>、 <788>和<789>。图5显示了LE400传感器的工作原理,即穿过传感器的颗粒会散射并遮蔽入射光和校准,随后借助校准曲线将脉冲信号转换为颗粒尺寸。
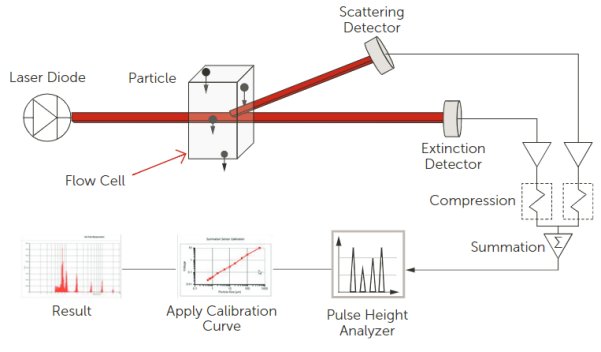
图5. AccuSizer LE400传感器的工作原理
2.1 流程
首先,清洁500 mL瓶子,并装满过滤后的去离子水,然后使用AccuSizer SIS仪器分析去离子水的颗粒尺寸和数量来确定背景计数(空白)。接下来,经过滤的去离子水在重力作用下流经这些器械,并收集在洁净的瓶子里。原始结果以每毫升多少颗粒数的形式呈现,因此将报告结果乘以500以反映 500毫升中的总颗粒数。
所有测量均使用相同的测量方法:
1) 抽取0.5mL的皮重体积
2) 每次取5mL样品进行测试,共计4次
3) 舍弃第一个结果
4) 将第二到第四个结果取平均值
5) 结果以颗粒/mL为单位进行报告
该测量方法符合USP <788>。结果以大于0.5、2、5、10、25、50和100μm的粒径范围进行报告。ISO 8536标准中未对25μm以下的尺寸做出要求,且在最终计算中也不使用这些尺寸的数据,但更小尺寸范围的测量结果有助于量化输液器清洁度之间的差异,而这种差异在仅统计大于25μm的颗粒时是不容易被注意的。
2.2 结果
空白计数的结果如图6所示。注意,当粒径大于10μm的时候,其计数均为零。这意味着在最终计算中不需要进行空白扣除。
图6. 空白背景计数
图7展示了通过比较输液器品牌B和输液器品牌C所得到的以每毫升颗粒数形式的原始数据结果。
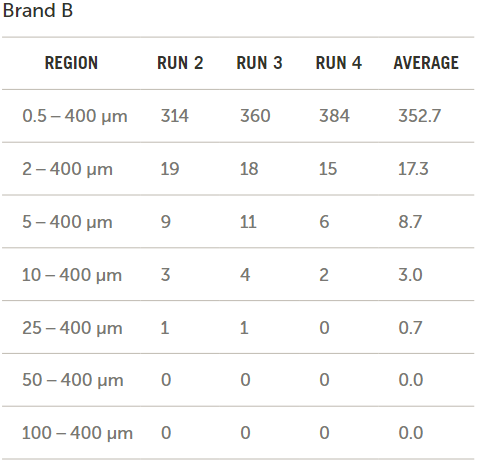
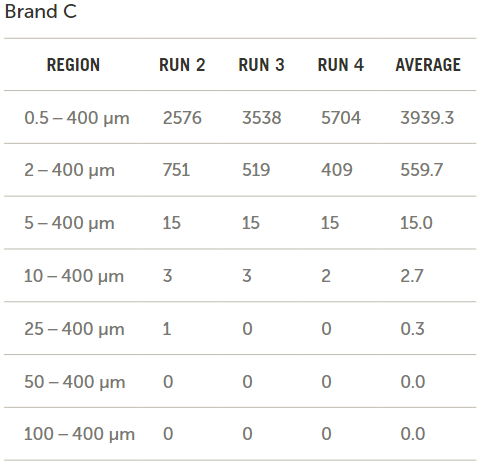
图7. 品牌B和C原始数据的对比
按照ISO 8536中的说明,使用平均数据计算最终n值。这些计算结果如图8所示。
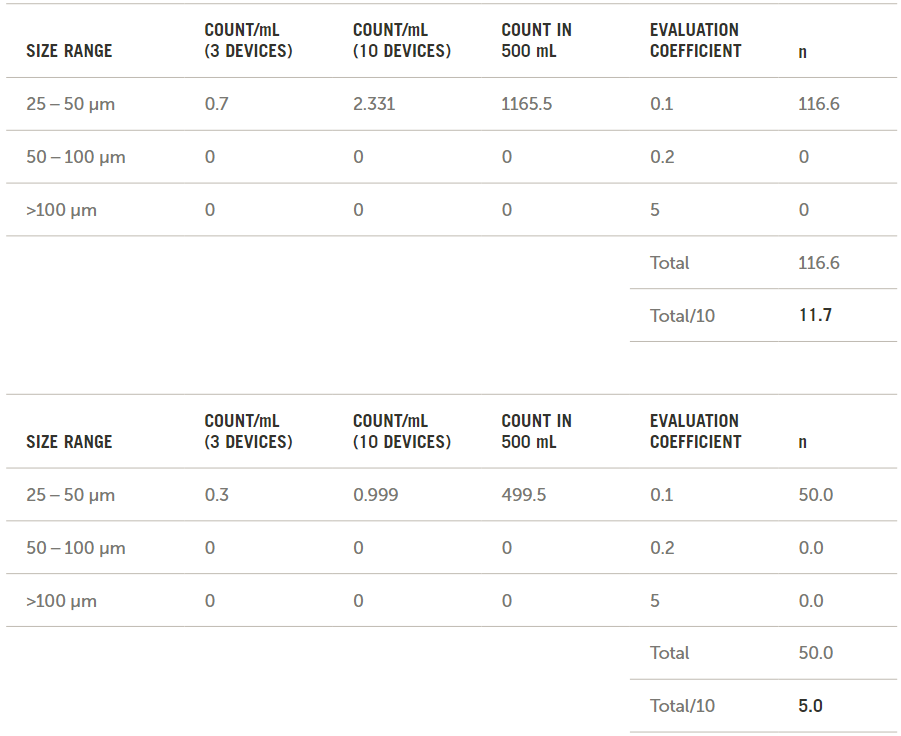
图8. 根据ISO 8536计算的n值
本研究的方法验证是依托于制备10μm和25μm的聚苯乙烯乳胶(PSL)标准品混合物进行的。对初始浓度进行了分析,然后让其在重力作用下流经一套静脉输液器,收集流经后再次进行分析。图9展示了以每毫升颗粒数为单位的初始样品(蓝色)和留存样品(红色)的分析结果。
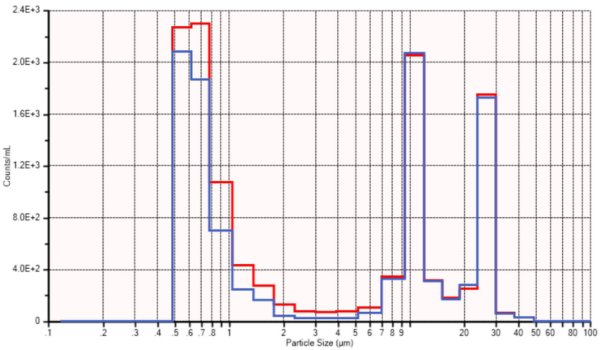
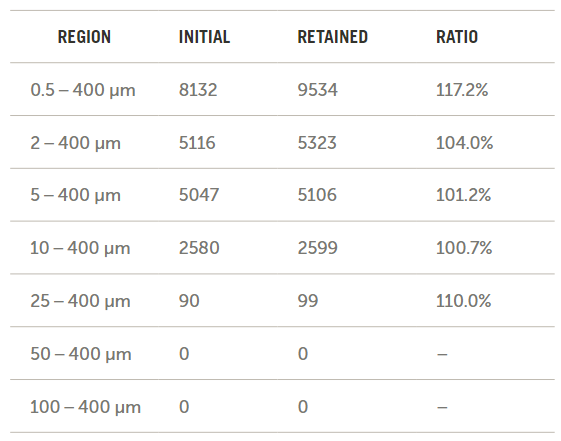
图9. 颗粒滞留研究
尽管这份应用笔记的作者拥有超过35年的粒度测量经验,但此次滞留研究仍是一项艰巨的挑战,并且图9中所展示的仅仅是最佳结果。建议购买市面上可买到的颗粒计数标准品以推动这一流程。
本研究中所检测的输液器非常干净,很容易就通过ISO 8536标准。虽然显微镜检测法的优势在于能够更好地鉴别纤维,但液体颗粒计数器检测速度更快、操作更简便,并且能够报告低至0.5μm的检测结果,通常能就相对清洁程度提供更多细节信息。
三、实验:肠内营养袋
在这项研究中,通过网络购买了几包容量为1200mL的肠内营养输送袋。尽管对于这些特定的医疗设备并没有相关标准或限制,但所购买的产品包括静脉输液(IV)型袋以及输送装置,这为颗粒污染检测提供了一种成本低廉且具有代表性的输送系统。对这些设备采用了与输液器类似的测试程序。首先通过对过滤后的去离子水和瓶子进行测试,来建立一个干净的背景环境。将这些袋子里装满了1000mL的清洁水,在重力作用下让水依次流经整个设备,然后将水收集在一个洁净的瓶子里。按照USP<788>的操作规程,在AccuSizer SIS系统上对收集到的水进行了分析,即测量四批5mL的样品,然后计算并报告第二次到第四次测量所得的每毫升颗粒浓度。
干净水和瓶子的结果如图10所示。由于不存在>10 μm的颗粒,因此其他实验不需要扣除背景。
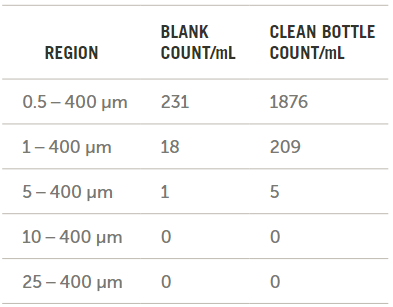
图10. 空白瓶和干净瓶中的颗粒计数
流经三个袋子和输送系统后所收集到的流出物的颗粒浓度结果(以每毫升的颗粒数表示)如图11所示。然后将袋子1重新装满水并手动搅拌,以确定通过施加额外能量来去除袋子表面的颗粒是否会增加流出物的颗粒计数。
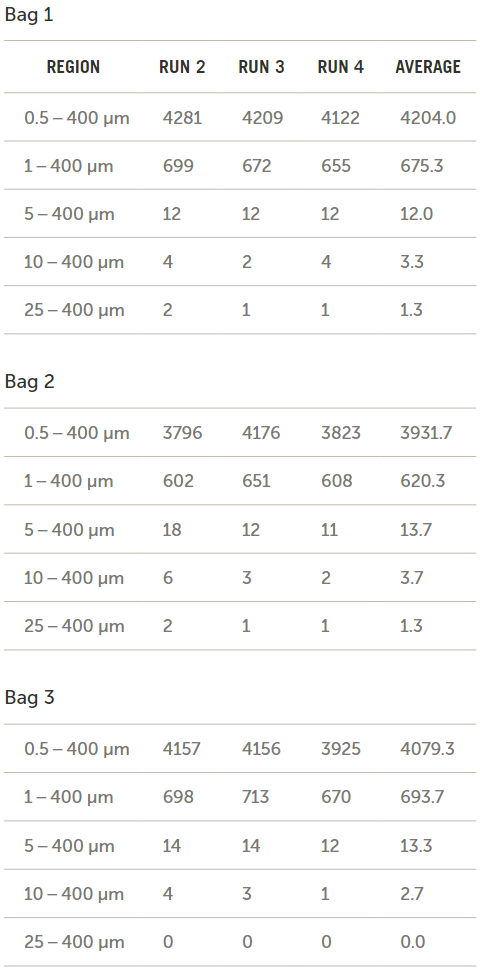
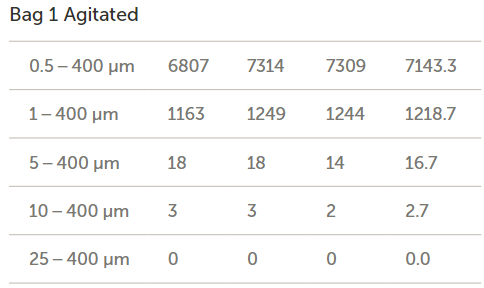
图11. 肠内营养袋中的颗粒计数
AccuSizer SIS软件能够自动报告USP<788>中大容量注射剂的合格/不合格标准,如图12中针对袋子1测试所展示的那样。所有经过测试的器械都通过了USP< 788 >中大容量注射剂的限量要求。
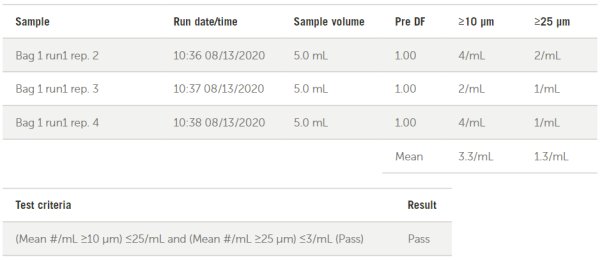
图12. 袋子1 USP<788>大容量注射剂报告
3.1 结论
众多标准、美国药典(USP)测试以及美国食品药品监督管理局(FDA)的指导文件都为医疗器械中的微粒污染提供了测试方法和验收标准。但终端用户往往需要对这些文件进行解读,将相关原则应用到他们特定的器械上,并限定可接受的微粒数量。使用英特格(Entegris)公司的AccuSizer SIS液体微粒计数器可实现微粒尺寸和计数及报告的自动化,这通常使得分析测量成为整个流程中较容易的部分。




