 钻石会员
钻石会员
 已认证
已认证
1背景
摘要:
在复杂注射剂的研发和制剂开发中,处方筛选至关重要,它直接关系到药物的有效性、稳定性和安全性。本文主要介绍了 LUMiSizer稳定性分析设备在处方筛选中的作用,如快速进行处方筛选,以节省研发时间,并通过两个案例进行了具体分析。在丙泊酚脂肪乳剂的案例中,LUM系列稳定性分析仪可快速、直接地表征其在原浓度下的稳定性,加速和自然重力条件下的分离行为一致,透光率图谱与目视结果和长期存放结果匹配,且附加粒径测试功能与 LD/DLS 结果匹配,符合稳定性测试多项标准。在基于丙交酯乙交酯共聚物(PLGA)纳米胶囊的蒽醌衍生物用于光动力治疗的研究中,LUMiSizer 可分析 NC(可生物降解聚合物纳米胶囊) 分散体的稳定性,为该研究提供了有力支持。
关键词:处方筛选,稳定性分析,LUM
LUM应用到处方筛选中,可以进行颗粒分析:LUM 可准确测量药物颗粒大小和分布,对优化制剂溶解性和稳定性至关重要。例如,发现颗粒过大影响溶解性时,可调整制剂工艺减小颗粒尺寸,提高药物溶解性和生物利用度。制剂稳定性评估:LUM 可监测制剂在不同条件下的稳定性,及时发现潜在问题并采取措施改进。如发现制剂储存中出现颗粒聚集,可调整辅料解决稳定性问题。以及处方优化:基于 LUM 提供的信息,选择合适辅料和制备工艺,提高制剂性能和质量。接下来通过两篇文献来重点探讨LUM稳定性分析设备在处方筛选中的作用。
2处方筛选的重要性
处方筛选可以确保药物稳定性。例如,对于易氧化的药物可添加抗氧化剂,对pH敏感的药物选择合适缓冲体系,防止在储存和使用中发生降解、氧化、水解等反应。优化药物释放特性。如通过选择高分子材料作为缓释载体控制释放速度,延长作用时间;利用脂质体、纳米粒等载体技术实现靶向输送,提高疗效并降低副作用。提高药物生物利用度。例如,采用微乳、纳米混悬液等技术增加难溶性药物溶解度;为蛋白质、多肽等生物大分子药物选择合适保护剂和稳定剂,防止体内降解。降低副作用风险。控制药物释放速度可避免突释现象,减少对局部组织刺激;选择低毒性辅料降低制剂整体毒性。适应特殊给药需求。对于眼部注射剂,选择对眼部无刺激性辅料并确保药物在眼部保持适当浓度和作用时间;脑部注射剂需选择能穿越血脑屏障的载体材料实现靶向输送。提高制剂可制造性。选择合适辅料和制备工艺确保制剂稳定性和一致性,便于大规模生产,同时降低成本提高市场竞争力。
3LumiSizer分散体分析仪介绍
按照GB∕T41316-2022 TR 13097 分散体系稳定性表征指导原则,稳定性是指分散体系在指定条件或类似条件下贮存和使用一段时间后,稳定性指标保持阈值范围内的能力。因此,稳定性指标取决于其应用。对于特别稳定的产品,为了获取预定的稳定性判据,需要使用高分辨率或敏感的分析技术,也可以使用加速变化的方法。
稳定性参数可分为:分散相的质量浓度或体积浓度、连续相的状态(如:密度、黏度、表面张力、化学势、溶剂质量)、分散相的状态(如:粒径、粒形和密度分布,液滴的黏度、颗粒形变、颗粒表面结构)、颗粒/液滴间相互作用力(如:静电力和范德华力、空间阻力和耗散力)、分散相和连续相间相互作用;分散体系可能会发生团聚、聚并、乳析、絮凝、上浮、沉降、奥氏熟化、相转化等稳定性丧失现象。可采用目测法、仪器法、关联法等方法对分散体系状态变化进行表征。
根据《中国药典2020版》《9001 原料药物与制剂稳定性试验指导原则》,稳定性试验的目的是考察原料药物或制剂在温度、湿度、光线的影响下随时间变化的规律,为药品的生产、包装、贮存、运输条件提供科学依据,同时通过试验建立药品的有效期。
稳定性试验的基本要求是:(1)稳定性试验包括影响因素试验、加速试验与长期试验。影响因素试验用1批原料药物或1批制剂进行;如果试验结果不明确,则应加试2个批次样品。生物制品应直接使用3个批次。…… 4)研究药物稳定性,要采用专属性强、准确、精密、灵敏的药物分析方法与有关物质(含降解产物及其他变化所生成的产物)的检查方法,并对方法进行验证,以保证药物稳定性试验结果的可靠性。在稳定性试验中,应重视降解产物的检查。……(7)制剂质量的“显著变化”通常定义为:①含量与初始值相差5%;或釆用生物或免疫法测定时效价不符合规定。②降解产物超过标准限度要求。③外观、物理常数、功能试验(如颜色、相分离、再分散性、粘结、硬度、每揿剂量)等不符合标准要求。④pH值不符合规定。⑤12个制剂单位的溶出度不符合标准的规定。
需要指出的是:本文中所述及的稳定性分析和药典中的稳定性分析概念不相同。
LUMiSizer全功能的分散体分析仪(德国LUM公司),采用离心分离分析方法来预测制剂的稳定性。使用STEP技术(空间、时间消光图谱),对样品的整体空间范围用平行近红外或蓝光照射,通过光学传感器CCD检测透光率以获得空间和时间消光图谱,从而快速表征分散体系(乳液或悬浮液)中的不稳定现象,如漂浮或沉降等,来预测制剂的稳定性。
使用LUMiSizer测试稳定性,比用肉眼在自然重力下观察试管的分离过程快2000多倍。只需数分钟或数小时,而不是几个月或几年,就能完成分散体在原始浓度下的快速稳定性排序和货架期预测,获得的结果与正常重力下的结果一致。可以很轻松的检测出沉积层和网状结构颗粒的可压缩性。
需要注意的是,LUMiSizer 设备是通过STEP技术,测量透射光强度、离心场速度分布和颗粒尺寸分布等,关注的是分散体系中颗粒或相态之间的相互作用,在物理层面(如颗粒的运动、分布等)的稳定性。这里的稳定性概念不同于药物分析中的稳定性,药物分析中的稳定性是采用多种分析方法和技术手段,来评估药物的化学组成、杂质情况、物理稳定性、微生物稳定性等。
4案例分析——丙泊酚脂肪乳剂的稳定性分析及粒径测试
背景:
脂肪乳作为新的载药剂型,具有诸多优点,比如:对于易氧化的药物,脂肪乳可添加抗氧化剂,确保药物稳定性,可以提高疗效并降低副作用,可以适应特殊给药需求等等。许多药物以其为载体。丙泊酚是一种新型快速、短效静脉麻醉药,常制成脂肪乳剂。影响脂肪乳剂稳定性的因素众多,包括原料选择、处方筛选、制备工艺、物理和热力学影响、液滴大小和分布、包装材料、储存条件等[1]。
问题:
在对丙泊酚脂肪乳剂进行生产工艺调整后,其制备的乳剂几个月内变得不稳定,但激光衍射(LD)和动态光散射(DLS)分析未发现“新鲜样品”与之前的差别。几个月后用LD、DLS测试发现粒径有变化,但这些方法发现问题较晚,需要长达数月才能发现问题。因此需要尽早对产品进行可靠的稳定性表征,以避免生产浪费、批次召回和利润损失等危机。
使用设备:
LUMiReader PSA稳定性分析仪(静置型),测试条件:1g,38h,25℃。

LUMiSizer稳定性分析仪(加速型),测试条件:2300g,2h,25℃。

结果:
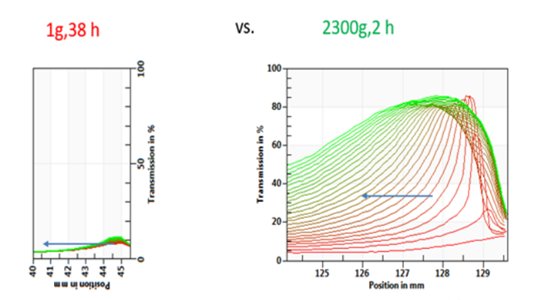
图1是,同一个丙泊酚脂肪乳剂样品在LUMiReader PSA®里静置38h后与在LUMiSizer®里加速测量2h后(对底部进行了局部放大)的透光率图谱比较。横坐标对应的是样品管的位置,左边是样品管的顶部,右边是样品管的底部;纵坐标是透光率数值。
同一个丙泊酚脂肪乳剂在不同的测试仪器/条件下,均出现液滴上浮导致底部透光率升高的现象,且图谱性质和趋势一致,说明加速条件适用于该样品测试。
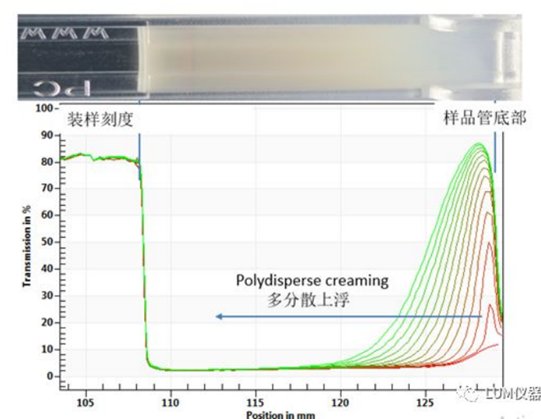
图2是丙泊酚脂肪乳剂在LUMiSizer®里加速测量2h后的透光率图谱与实物照片的比较。丙泊酚脂肪乳剂在加速测量中出现典型的多分散上浮现象,与肉眼观察一致。
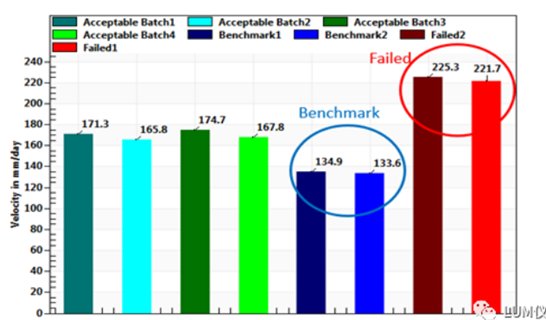
图3是用LUMiSizer®定量比较不同批次丙泊酚脂肪乳剂的上浮速度;基准样品的上浮速度最慢,稳定性最好;生产工艺调整后数月内不稳定的样品上浮速度最快,最不稳定。
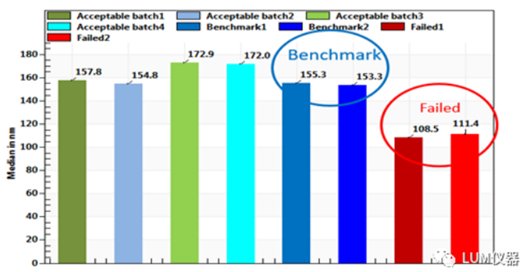
图4是不同批次的1:20比例稀释后的丙泊酚脂肪乳剂在LUMiSizer®里测试得的液滴平均粒径的比较。生产工艺调整后不稳定的样品平均粒径最小,推测是较小纳米颗粒的布朗运动剧烈导致样品更不稳定,且粒径与稳定性不存在直接联系。影响稳定性的因素很多,粒径是其中之一。
结果与讨论:
LUM系列稳定性分析仪可快速、直接地表征丙泊酚脂肪乳剂在原浓度下的稳定性,加速和自然重力条件下的分离行为一致,透光率图谱与目视结果一致,与长期存放结果匹配。LUMiSizer附加粒径测试功能,与LD/DLS结果匹配,符合稳定性测试多项标准,满足药企的21 - CFR - Part和GLP认证。
5案例分析——基于PLGA纳米胶囊的蒽醌衍生物研究
背景:
光动力疗法(PDT)是一种基于单色可见光和光敏剂化合物组合的治疗协议,用于治疗许多皮肤疾病,现已扩展到包括医美等领域,然而,一些光敏剂药物水溶性差且具有毒性,使用生物技术和纳米技术开发获取具有生物相容性的光活性化合物。PDT 的机制是光敏剂分子在特定波长的可见光照射下,引发一系列光化学反应,产生自由基、单线态氧和活性氧物种(ROS),从而破坏目标组织。获得新的光敏分子的生物技术途径为制药行业提供了一种可行且经济的选择,本研究旨在开发和表征一种含有蒽醌衍生物的可生物降解聚合物纳米胶囊(NC)作为新的光敏剂[2]。
材料与方法:
制备纳米胶囊:根据 Fessi 等人的方法并进行修改,通过纳米沉淀或界面沉积预制聚合物的方法制备 NC,将含有磷脂、油、共聚物 PLGA 和红色染料蒽醌(RD)的有机相加入含有非离子表面活性剂的水相中,通过旋转蒸发去除有机溶剂。
表征项目:
粒径、多分散指数(PdI)和 Zeta 电位;原子力显微镜(AFM)分析;吸收和荧光发射光谱 UV/Vis 测试;荧光寿命光谱测试;细胞培养、细胞毒性测试;体外光动力治疗测试等。
加速稳定性测试(LUMiSizer)
在采用STEP技术(空间和时间分辨消光曲线)的分散分析仪LUMiSizer上,分析NC分散体的稳定性。该研究同时记录了作为时间和空间的函数的透射光强度(在880 nm处)。
测量在25℃下进行;在3618 rpm的转速下,每65秒采集一条谱线,持续476分钟,半径位置为129.5 mm。
在分析离心过程中,通过稳定性分析,用空载/NC(A)和RD/NC(B)获得的归一化NIR透射曲线,进行对比分析。第一条和最后一条透光率谱线分别以红色和绿色显示。
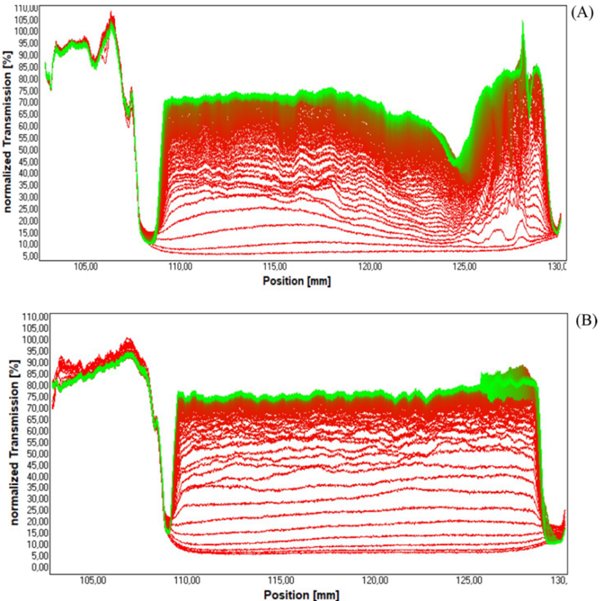
图5. Unloaded/NC、RD/NC 稳定性分析谱图
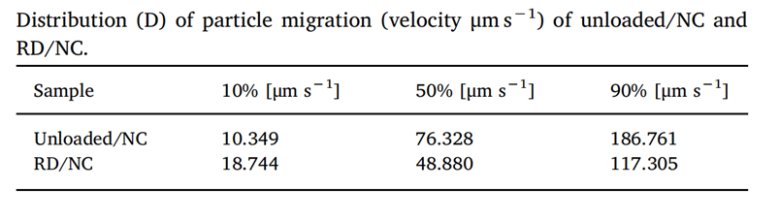
表1.Unloaded/NC、RD/NC 分散速度
结果:
从上图分析可知,加载 RD 后 NC 的稳定性未改变,RD/NC 的速度分布比未负载的 / NC 窄,在分散体系中,速度分布反映了颗粒的运动状态,较窄的速度分布表明颗粒的运动速度相对集中在一个较小的范围内,颗粒相对更均一,从而推测RD 封装可以提高 NC 配方的稳定性。通过指纹谱图及速度分布综合评估产品稳定性,及预估效期。
LUMiSizer能够快速表征分散系统(乳液或悬浮液)的不稳定性现象,如上浮或沉降。沉淀。通过LUMiSizer测量的速度示于表1中,从而表征RD/NC 和Unloaded/ NC的分散稳定性。
该分析仪的结果为进一步研究和应用基于 PLGA 纳米胶囊的蒽醌衍生物用于光动力治疗提供了有力支持。
6总结
处方筛选能确保药物稳定性、优化药物释放特性、提高药物生物利用度、降低副作用风险、适应特殊给药需求以及提高制剂可制造性。随着药物研发的不断发展,对处方筛选的要求将越来越高。LUM 设备通过STEP技术,可快速、直接地评估产品稳定性,从而评估药物效期,大大提高处方筛选效率,为药物研发提供更可靠的支持。



