 钻石会员
钻石会员
 已认证
已认证
本文隶属于一体化解决方案系列,全文共 3107字,阅读大约需要 12分钟
摘要:
复杂注射剂的粒径控制是其制备中的关键一环,注射剂的平均粒径、不溶性颗粒以及尾端大颗粒是其质量控制的重要内容。Entegris(PSS)公司利用Nicomp系列仪器进行平均粒径与粒径分布检测,利用AccuSizer系列仪器进行不溶性颗粒与尾端大颗粒检测,将两者结合起来可以对复杂注射剂进行整体粒度表征。
关键词:
复杂注射剂;平均粒径;不溶性微粒;尾端大颗粒
一、引言
复杂注射剂是以注射途径给药的非均相体系,如微乳/亚微乳、脂质体、微球、纳米乳、蛋白、胶束、环糊精包合物等。国内往往也将复杂注射剂称为特殊注射剂。复杂注射剂的粒径控制是其制备中的关键一环,很大程度上影响了复杂注射剂质量。药物粒度大小可以直接影响药物溶解度、溶解速度,进而影响到临床疗效,降低粒径可以降低难溶性药物的生物利用度、增强药物疗效和实现药物的靶向作用等作用。同样关注粒径变化也是对于制剂稳定性分析中重要的参考指标。另外原辅料及相关制剂的粒径大小对于药物性能和一致性评价至关重要[1]。
二、粒径控制的关键点
复杂注射剂的平均粒径、不溶性微粒以及尾端大颗粒通常是粒径控制的关键点。
2.1 平均粒径
平均粒径是目前是最常见的检测指标,例如对于静脉注射乳剂而言,平均粒径多在100-500nm之间,若平均粒径过小则会降低药物在体内的有效浓度和持续时间,增加毒副作用的风险,过大则易发生血管堵塞与局部组织损伤。另外相关指标还有D10,D50,D90等。复杂注射剂一般都是纳米及亚微米剂型(微球一般在微米级别),一般采用动态光散射法仪器进行检测,通过平均粒径、D90、PI、Span等值作为质量控制指标。
2.2 不溶性微粒
不溶性微粒往往是造成不良反应的重要原因,各国药典针对静脉注射明确要求控制10μm及25μm以上不溶性微粒的范围,中国药典CP0903《不溶性微粒检测法》指出“标示装量为100ml或100ml以上的静脉用注射液除另有规定外,每1ml中含有10μm及10μm以上的微粒数不得超过25粒,含25μm及25μm以上的微粒数不得过3粒;标示装量为100ml以下的静脉用注射液、静脉注射用无菌粉末、注射用浓溶液及供注射用无菌原料药,除另有规定外,每个供试品容器(份)中含有10μm及10μm以上的微粒数不得超过6000粒,含25μm及25μm以上的微粒数不得过600粒”。但是区别普通注射剂,复杂注射剂往往需要根据本身特色来制定检测方案。例如对于蛋白注射剂中的不溶性微粒,美国药典要求更关注小于10μm的粒子,并建议将小于10μm的粒子分为2-5μm和5-10μm两组,表明对于蛋白注射剂而言,小于10μm的颗粒会对药物的安全性和有效性产生重要影响。
2.3 尾端大颗粒(LPC)
稳定性研究一直是制剂里面重要的一项,引起不稳定的因素有很多,异常颗粒或者说尾端大颗粒往往受到忽视,以脂肪乳注射剂为例,平均粒径一般在100nm-300nm,但是5μm以上的乳粒往往大量存在,而这些尾端大颗粒的存在一方面会吸附小颗粒,变成更大的颗粒,导致稳定性差,造成破乳、油相分离等现象,出现质量问题;另一方面,尾端大颗粒进入人体后,很容易造成静脉炎、栓塞等不良反应,甚至导致患者死亡。传统粒度检测方法很难精准检测到尾端大颗粒的存在,从而造成研发人员的忽略。因此,对于脂肪乳而言,药典建议通过光阻法来检测>5 μm的大乳粒,即PFAT5值。但是现在随着研发的深入,尤其是制备的制剂粒径越来越小,很多厂家已经开始主动关注更小尺寸的尾端大颗粒。
三、粒度检测方法
3.1 平均粒径
(1)纳米及亚微米剂型
微乳/亚微乳、脂质体、纳米乳、纳米微泡、注射混悬剂(纳米晶、结合蛋白)等复杂注射剂的平均粒径,一般通过动态光散射法(纳米粒度仪)进行平均粒径的检测。利用Nicomp系列仪器对不同复杂注射剂进行平均粒径检测。
表1 多种剂型的平均粒径结果检测
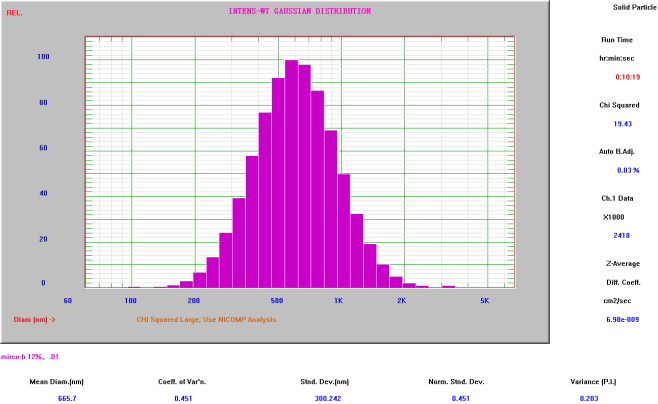
脂肪乳注射剂平均粒径
(Nicomp Z3000 检测结果:≈200nm)
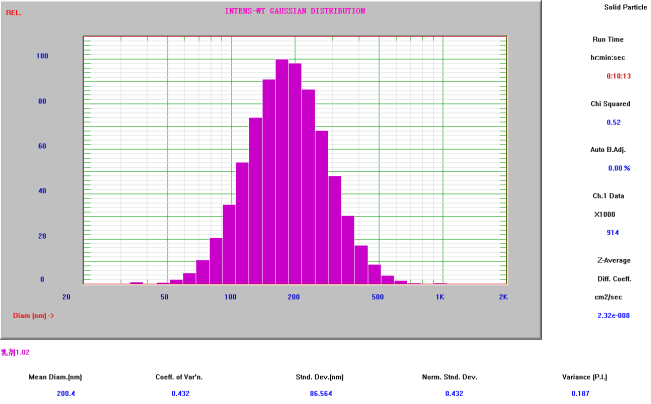
脂质体平均粒径
(Nicomp Z3000 检测结果:≈189nm)
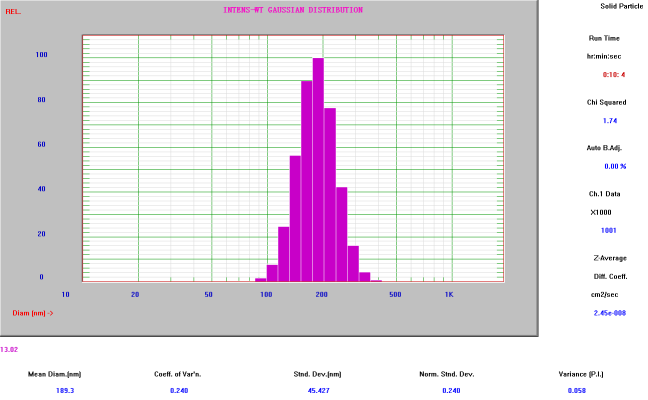
纳米乳平均粒径
(Nicomp Z3000 检测结果:≈51nm)
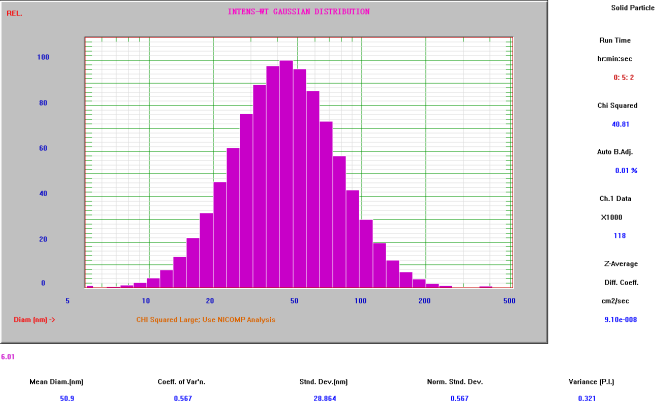
微泡平均粒径
(Nicomp Z3000 检测结果:≈ 666nm)
蛋白注射剂平均粒径
(Nicomp Z3000 检测结果:≈18nm)
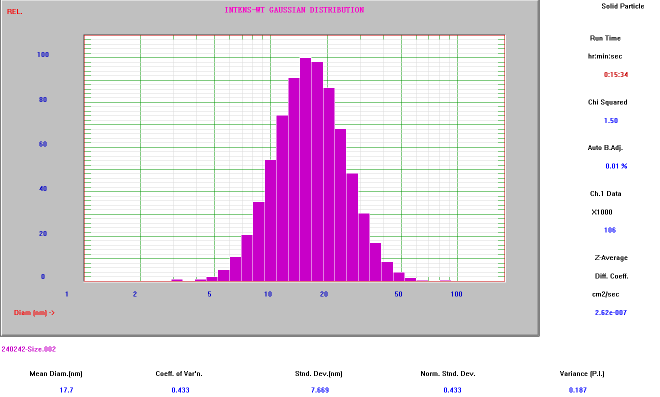
胶束平均粒径
(Nicomp Z3000 检测结果:≈13nm)
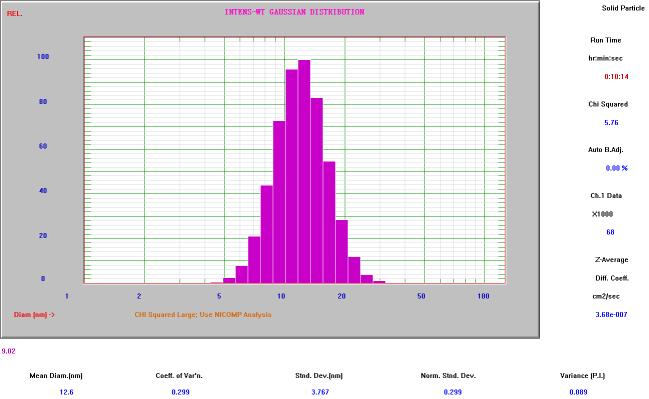
(2)微米剂型
微球、微泡等一般通过单颗粒光学传感技术的光阻法检测平均粒径,从而获得真实粒径分布,保证质量安全。也可以通过激光衍射仪检测平均粒径,对比原研制剂,控制粒径范围。利用AccuSizer系列仪器对不同复杂注射剂进行平均粒径检测。
表2 微米级复杂注射剂的平均粒径结果检测
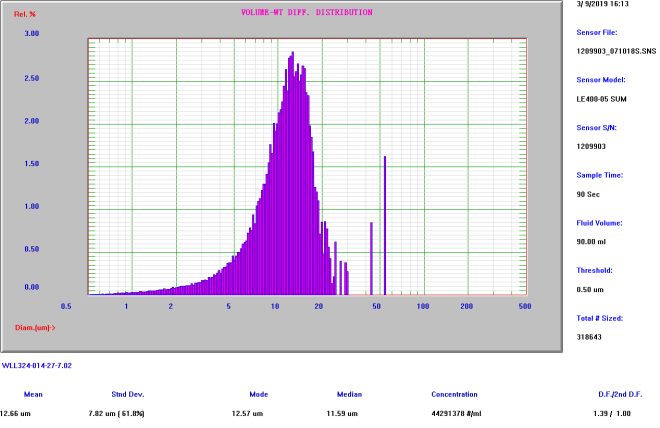
微球平均粒径
(AccuSizer A7000检测结果:体积径≈13μm)
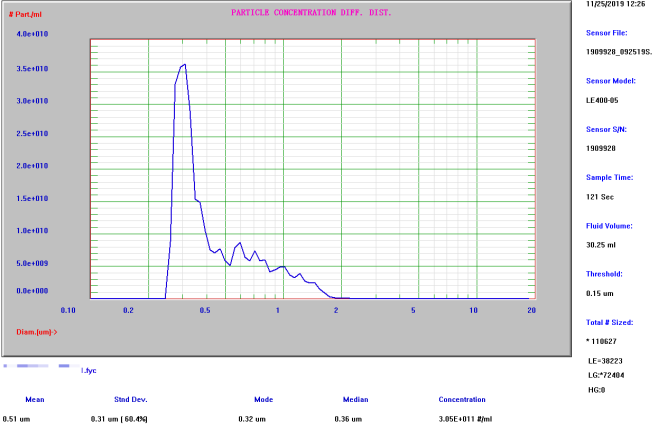
微泡平均粒径
(AccuSizer A9000检测结果:≈0.51μm)
3.2 不溶性微粒
目前最常用的检测不溶性微粒的方法是光阻法(光消减、光遮蔽)。
(1)蛋白类注射剂的不溶性微粒
由于蛋白类注射剂本身粒径很小,一般直接进行检测,即可获得不溶性微粒结果。需要注意的是,蛋白类注射剂往往是小剂量型,可采用微量进样系统,AccuSizer A2000USP最小进样量低至180μL,或采用多支混合后检测获得数据。FDA指导文件中指出蛋白类注射剂需关注更小粒径的不溶性微粒,具体案例可参考后续内容。
(2)微球的不溶性微粒
由于微球本身的粒径范围属于不溶性微粒检测范围,所以微球的检测一般通过特殊溶剂溶解掉微球本身后,检测溶剂里的不溶性微粒。
(3)脂肪乳注射剂的不溶性微粒
脂肪乳注射剂中乳粒浓度很高,并且包含大量的大乳粒,属于一种特殊意义上的不溶性微粒,目前仅检测PFAT5,部分药企在研发阶段会通过显微镜或者溶掉乳粒的方法进行检测。
3.3 尾端大颗粒
(1)脂肪乳注射剂PFAT5
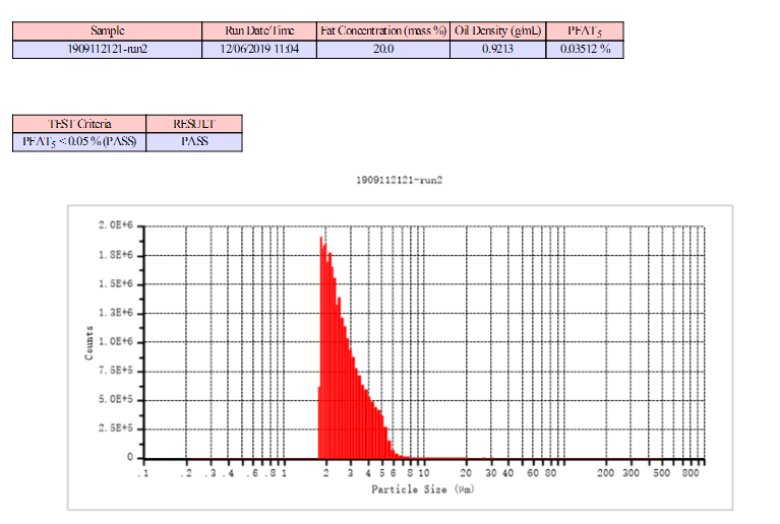
脂肪乳注射剂的尾端大颗粒曾造成过严重的医疗事故,从而引起了对尾端大颗粒的关注,目前药典要求必须检测尾端大于5μm的乳滴占油相体积比例小于0.05%即PFAT5<0.05%。利用AccuSizer系列仪器对脂肪乳注射剂的PFAT5进行检测。
表3 脂肪乳注射剂PFAT5检测
脂肪乳PFAT5
(AccuSizer A7000 APS检测结果)
(2)蛋白聚集
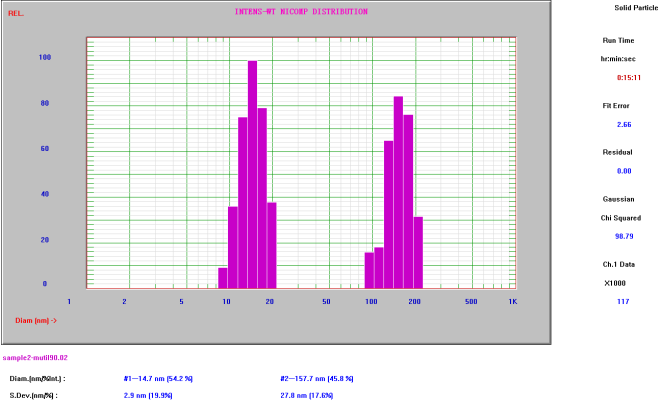
蛋白的平均粒径通常在几纳米至几十纳米左右,但蛋白非常容易团聚,其团聚体通常在亚微米级别。对蛋白聚集检测一般通过带有多峰分布的纳米粒度仪进行定性分析,也可以通过可集聚光束的光阻法进行计数分析。利用Nicomp与AccuSizer系列进行定性检测与定量检测。
表4 蛋白聚集检测
蛋白聚集定性检测
(Nicomp Z3000检测结果)
蛋白聚集定量检测
(AccuSizer A9000 FX-nano-SIS检测结果)
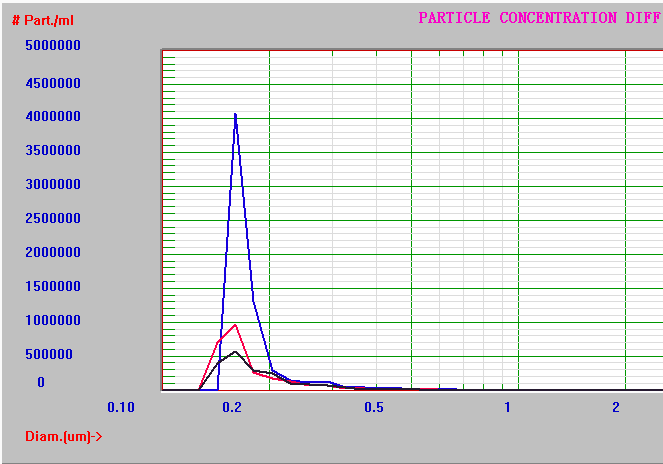
(3个蛋白样品聚集差异)
(3)注射混悬剂尾端颗粒
对于混悬剂而言,尾端大颗粒尤其是微米级别的颗粒含量对质量影响严重。大颗粒的存在会加速混悬剂的沉降速度,影响其稳定性;也会降低混悬剂的生物利用度和药效,从而影响治疗效果。通过基于单颗粒光学传感技术的光阻法,可以定量分析尾端颗粒含量及分布情况。从而达到对尾端颗粒进行分析,进而改善工艺,控制质量。AccuSizer系列颗粒计数器通过单颗粒传感器技术(SPOS),具有1024数据通道,最小可区分0.01 μm颗粒粒径差异。
表5 注射混悬剂尾端大颗粒检测
注射混悬剂尾端大颗粒
(AccuSizer A7000 AD检测结果)
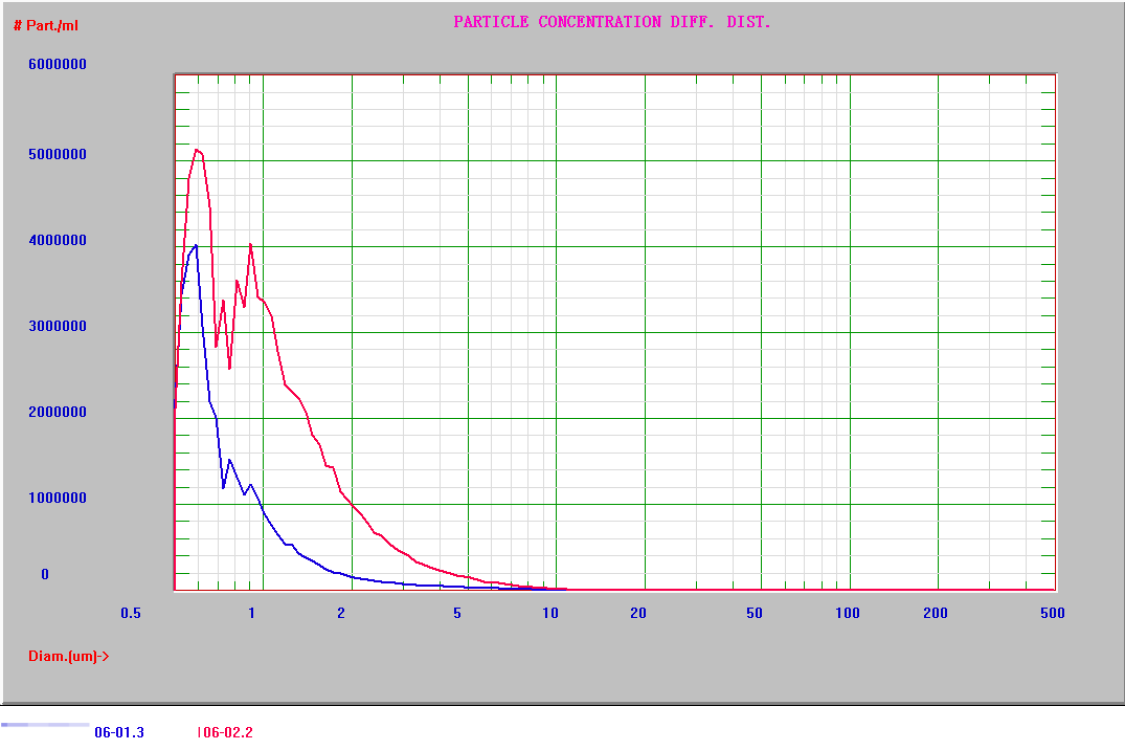
(两种混悬剂尾端颗粒分布差异)
(4)脂质体
PF文件建议脂质体在关注平均粒径的同时,也要关注“大颗粒”的影响,尾端大颗粒的存在往往会吸附小颗粒,影响脂质体稳定性。不同制备工艺下脂质体粒径及尾端大粒子分布结果差异很大,可以通过Nicomp 多峰分布和AccuSizer A7000计数根据实际粒径情况分析尾端颗粒变化。
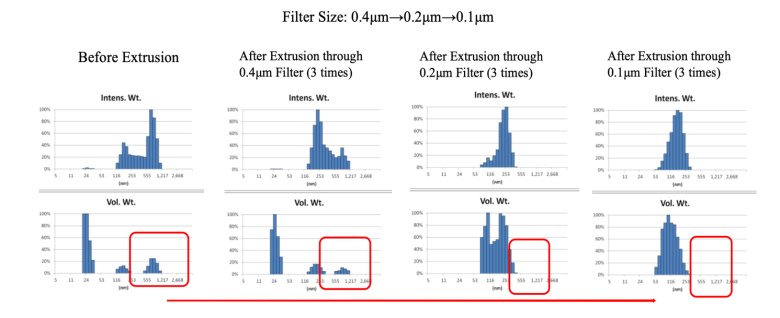
图1 不同孔径滤芯过滤对脂质体尾端大颗粒的影响[2]
四、粒度检测解决方案
Entegris(PSS)可以提供复杂注射剂粒度检测问题的最优化方案,其中准确分析尾端大颗粒更是利用了Entegris(PSS)独有技术进行开发而成,是全球先进的分析方法之一。

针对于不同类型的复杂注射剂,可以选用不同类型的仪器,Nicomp系列与AccuSizer系列仪器如图所示。

图2 Nicomp系列产品

图3 AccuSizer系列产品
参考文献
[1] 王云云.药物制剂技术[M].重庆大学出版社:201608.384.[2] Size Distribution of Various Types of Liiposomes Analyzed by Nicomp380 and Accu Sizer 780AD



