 白金会员
白金会员
 已认证
已认证
细胞系在某些培养条件下可能形成弱聚集的团聚体和更难分离的聚集体,譬如人胚胎肾细胞(HEK)(1)。通过软件算法准确统计团聚体和聚集体中的细胞数会有困难,可能会导致细胞计数不准确。为了减轻这种情况,在取样进行分析之前,可能需要优化样品制备方法,以消除或减少较大的团聚体和聚集体(2)。Vi-CELL BLU细胞计数和活率分析仪集成了软件功能,可以更准确地对细胞团块进行计数,在我们上一篇“团聚细胞计数的应用解决方案:Cell Type参数优化”应用短文中有更详细的描述。

如果软件不能有效识别和统计团聚体和聚集体中的细胞数量,Vi-CELL BLU细胞计数和活率分析仪软件将统计这些较大的细胞簇,并在图像中用红色方块标记它们(下图3)。由于软件对大型(有时是三维)细胞簇的细胞计数不准确,所以其中的细胞没有统计。但是,软件会统计并报告这些较大的细胞簇数量。通过查看细胞簇的数量,您可以检查特定样本的聚集程度。由于大聚集体可能对悬浮细胞培养产生负面影响,原因包括代谢扩散减少导致细胞生长不良,以及质粒和病毒颗粒无法到达内部细胞,引起转染和转导效率下降从而导致滴度降低(3),因此这种情况最好停止培养。如果检测确定细胞簇不可接受,但仍需要计数,则可能需要建立新的样品制备过程。
对于在某些条件下难以分离聚集体的细胞系,如一些HEK293细胞培养,需要额外的团聚分离优化策略,即得到分离良好的细胞悬液由Vi-CELL BLU细胞计数和活率分析仪检测,从而实现更准确的细胞计数。在本应用短文中,我们描述了不同的分离介质和移液吹打对贴壁HEK293细胞的聚集程度、存活率和活细胞计数的影响。我们还提供了一种侧样制备技术,可以在Vi-CELL BLU细胞计数和活率分析仪上获得更准确的计数结果,而无需改变传代培养细胞的现有分离方法。
在第一个实验中,测试了3种酶分离介质:胰蛋白酶、含EDTA的胰蛋白酶和TrypLE。此外,用1000µL移液枪上下吹打,在单个样品上测试每种分离介质。在第二个实验中,在初始胰蛋白酶处理后采集侧样本,并用TrypLE处理。
分离介质优化过程
1、HEK293细胞在T75细胞培养瓶中生长,在含有10%FBS的DMEM中融合率>70%。
分别准备两个培养瓶,用于测试胰蛋白酶、TrypLE和胰蛋白酶-EDTA作为分离处理
2、移除培养基,用5mL新鲜的无Ca2+、Mg2+离子的DPBS冲洗单层细胞。
3、加入2mL分离介质,轻轻摇动培养瓶以确保单层细胞完全被覆盖。培养细胞在37°C和5% CO2下孵育2分钟。
注意:轻轻摇晃细胞上的培养基可以确保单层细胞完全被分离分离介质覆盖,但是,敲击或摇晃培养瓶太剧烈可能会导致大簇细胞立即被移除。
4、孵育2分钟后,细胞完全从培养瓶中分离出来,加入10毫升含有10%FBS的温热DMEM,用10mL移液枪上下吹打5次,轻轻混合。
5、接下来将3mL培养细胞转移到四个5mL试管中,将12mL培养细胞分开。
两个试管被指定为未吹打对照,两个被指定为吹打后的样品。
-对于吹打好的样品,用1000µL移液枪上下吹打1000µL悬浮液10次。
6、将试管轻轻翻转3次进行混匀,将5个200µL的重复样本分配到Vi-CELL BLU细胞计数和活率分析仪样品管中,并在Vi-CELL BLU细胞计数和活率分析仪上测试结果。
通过在样品管和重复样本之间交替分析吹打后样品和未吹打对照品的结果。譬如,吹打管1-重复1,未吹打管1-重复1,吹打管2-重复1,未吹打管2-重复1。
7、通过使用Vi-CELL BLU细胞计数和活率分析仪上默认设置和Mammalian细胞类型分析样品。
8、对于每种分离介质,两个培养瓶中的样品检测重复该流程。
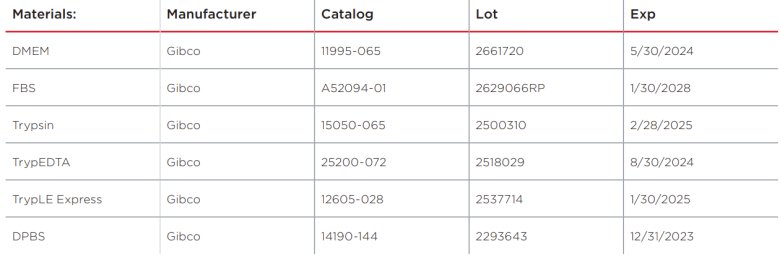
表1. 试剂清单
分离介质优化结果
与胰蛋白酶处理的样品相比,胰蛋白酶-EDTA和TrypLE处理的样品的平均细胞簇数量显著降低(p<0.05;Student's t-检验),表明使用胰蛋白酶-EDTA和TrypLE进行了更有效的细胞分离。胰蛋白酶-EDTA和TrypLE处理的样品细胞簇数量相似,表明两种分离介质的性能相似。胰蛋白酶-EDTA和TrypLE处理的样品,吹打能够显著降低细胞簇数量(p<0.05;Student’s t-检验),表明通过移液枪吹打得到更弱的细胞簇,然而,吹打不能分离胰蛋白酶处理样品中的聚集体。胰蛋白酶-EDTA和TrypLE的活细胞密度相似,组间无显著统计学差异(p>0.05;Student's t-检验)。在所有情况下,移液枪吹打都提高了存活率,这可能是由于在没有团聚体和聚集体的情况下采用了更有效的计数算法。
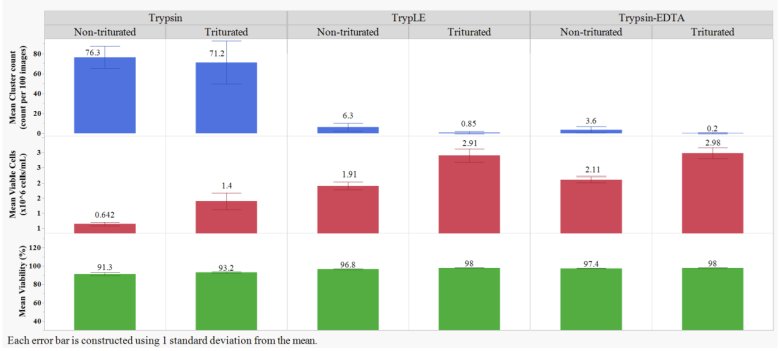
图1: 三种分离介质和吹打得到的平均细胞簇数量,平均活细胞密度和平均活率结果。结果是每组所有试管和培养瓶的所有重复的平均值。使用JMP 16.1.0版对数据进行分析。
侧样品分离方法
1、HEK293细胞在T75细胞培养瓶中生长,在含有10%FBS的DMEM中融合率>70%。
准备3个培养瓶来测试侧样品分离方法。
2、移除培养基,用5mL新鲜的无Ca2+、Mg2+离子的DPBS冲洗单层细胞。
3、然后,加入2mL胰酶介质,轻轻摇动培养瓶以确保单层细胞完全被覆盖。培养细胞在37°C和5% CO2下孵育2分钟。
4、孵育2分钟后,加入10 mL含有10%FBS温热的DMEM,用10mL移液枪上下吹打5次,轻轻混合。
5、接下来将3mL培养细胞转移到四个5mL试管中,将12mL培养细胞分开。
两个试管被指定为对照,另外两个被指定为侧样品。
将两个对照管翻转3次,从每个管中取出3个200µL的样品,并在Vi-CELL BLU细胞计数和活率分析仪上测试结果。它们被指定为未经处理的对照组,代表了现有的传代流程。剩余体积被指定为处理后的对照。
将两个侧样品管翻转3次,然后将所有4个管(两个2400µL对照管和两个3000µL侧样品管)在500 rcf下离心3分钟使细胞沉淀。
6、离心后取出培养基,将细胞重新悬浮在400µL含10%FBS的DMEM(用于2个处理过的对照管)或500µL TrypLE(用于2侧样品管)中,然后用1000µL移液枪上下吹打10次以重新悬浮细胞。
7、在室温下孵育2分钟后,将样品重新悬浮至初始体积(处理过的对照为2400µL,侧面样品为3000µL)。
8、用1000µL移液枪上下吹打样品10次混合,然后将试管翻转3次。
9、接下来,从每根试管中取五个200µL的重复样本,在Vi-CELL BLU细胞计数和活率分析仪上测试,在处理过的对照试管和侧样本试管之间以及重复样本之间交替测试,每种情况共测试10次。例如,处理过的对照管1-重复1,侧样品管1-重复1,处理过的对照管2-重复1,侧样品管2-重复1。
10、使用默认设置和Mammalian细胞类型分析所有样本。对总共3个培养瓶重复该流程。
侧样品分析结果
TrypLE处理的侧样本的细胞簇数量明显低于未处理和处理的对照组(p<0.05;Student's t-检验)。经过额外处理步骤的胰蛋白酶处理的对照组和经TrypLE处理的样本,VCD明显高于未经处理的对照组(p<0.05;Student’s t-检验)。处理过的对照组较高的VCD可能是由于额外的混合和移液步骤导致团聚体分离开。额外的处理显著降低了处理后对照组相比未处理对照组的存活率,略微降低了1.5%(p<0.05;Student's t-检验)。与未处理和处理的对照组相比,TrypLE处理显著提高了存活率(p<0.05;Student's t-检验),这可能是因为在没有团聚体的情况下计数更准确。
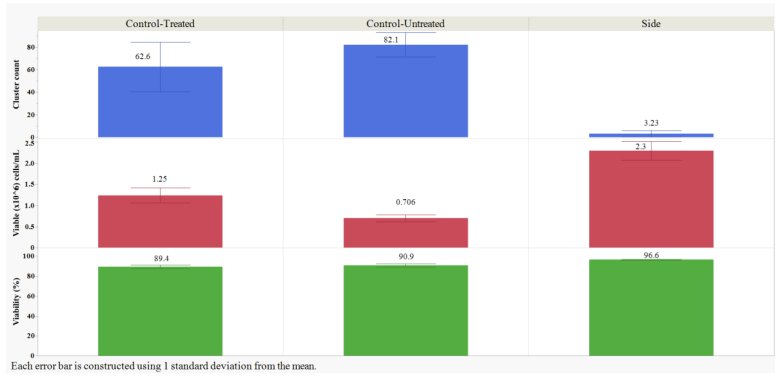
图2: TrypLE处理后侧样品,未处理对照和介质处理后的对照。它们的平均细胞簇数量,平均活细胞密度和平均活率结果。结果是每组所有试管和培养瓶的所有重复的平均值。使用JMP 16.1.0版对数据进行分析。
对图像的回顾显示了胰蛋白酶处理样本存在大的红色框标记和一些较小的细胞团聚体(图3左图)。TrypLE处理的侧样本(图3右图)显示了很少的细胞簇和较少的细胞团聚体。
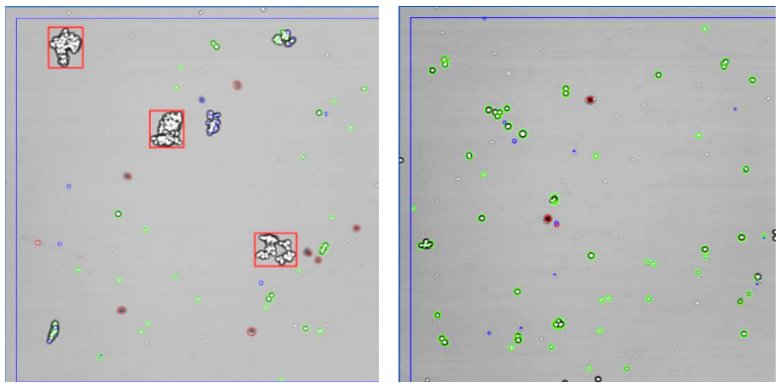
图3: 胰酶对照组(左)和TrypLE处理后的侧样品(右)的图像示例
讨论
如前所述,分离方法的选择会显著影响存活率、活细胞计数和聚集程度。通过移液枪进行温和地吹打可能会分离弱聚集的团聚体,并且允许在不降低细胞活率的情况下进行更准确的计数。对于更大、更难分离且对移液枪吹打反应不佳的细胞簇,用替代的分离介质,譬如胰蛋白酶加EDTA或TrypLE,可以使细胞悬浮液更加分离。
最后,若继续使用现有的分离方法,也可以选择使用侧样技术,从而在Vi-CELL BLU细胞计数和活率分析仪上实现更准确的计数。
● 参考文献:
1. Iuchi et al. Cytotechnology Feb 2020; 72(1): 131-140. Different morphologies of human embryonic kidney 293T cells in various types of culture dishes
2. ISO 20391-1:2018 Biotechnology – Cell Counting – Part 1: General guidance on cell counting methods
3. Tsap. Y et al. Biotechnology Progress 2000; 16(5): 809-814. Biomass and Aggregation Analysis of Human Embryonic Kidney 293 Suspension Cell Cultures by Particle Size Measurement
4. Drummen, N. Cell Type settings considerations for counting clumpy cells on the Vi-CELL BLU cell viability analyzer. Beckman Coulter application note. Content ID: 2023-GBL-EN-101699


