 白金会员
白金会员
 已认证
已认证
随着电子记录在制药领域的使用越来越普遍,作为生物制药企业常用的细胞计数和活率分析仪,来自GMP和FDA合规性方面的要求也越来越高。
在和各大生物医药公司做产品交流时,我们经常会收到以下问题:
1.操作软件是否具有审计追踪功能?
2.软件可以设置几级用户权限?
3.不同用户的账号和密码是否是独立和唯一的?
4.是否可以设置定期密码更新?
5.保存的数据是否以数据库形式保存?
6.数据是否可以备份和还原?
7.......
关于细胞计数和活率分析仪的合规性要求,为何大家都会提到审计追踪、用户权限、账号管理、密码控制、数据库保存和备份还原等问题?
为此,小编查阅了《中国药品生产质量管理规范(2010年修订版)》、2020年12月发布的《药品记录与数据管理要求》(试行)、FDA 21CFR Part 11和FDA行业指南:药物CGMP数据完整性和合规性的问答。关于合规性要求,这些法规都提到了一个术语:数据完整性(Data Integrity),而以上提到的问题基本都归属于数据完整性的范畴。
那到底什么是数据完整性以及如何评价数据完整性呢?
1、什么是数据完整性?
根据CGMP中的描述,数据完整性指的是完整的、一致的和准确的数据,这些数据需要是Attributable (可追溯性)、Legible(易读性)、Contemporaneous(同时性)、Original(原始性)、Accurate(准确性),缩写是ALCOA原则。
在FDA 21CFR 第 11 部分中, ALCOA 也被定义为完整、稳定一致且准确的数据。它是用来评估数据可靠性的基本原则。2018年FDA 21CFR Part11对数据完整性做了补充,增加了CCEA原则,即:Complete(完整性),Consistent(一致性),Enduring(持久性)和Available(可取性),统称ALCOA+。
2020年12月,中国国家药监局(NMPA) 开始施行药品记录与数据管理要求(试行)规定,其基本要求中指出,为保障药品质量和患者安全,必须在“从事药品研制、生产、经营、使用活动中,保证全过程信息真实、准确、完整和可追溯”,与FDA描述的ALCOA+原则是相一致的。
数据完整性在任何 CGMP 制造环境中都比以往更加重要,虽然数据完整性指南并不是一个新的概念,但随着电子记录已成为行业标准,对数据完整性的监管也在日益加强。
2、如何评价数据完整性
数据完整性中的数据包括原始数据和元数据,原始数据(Original Data)即测试生成的结果数据,通常直接描述产品的质量。元数据(Metadata)被定义为“关于数据的数据”,是理解原始数据所必需的数据,包括:日志文件、审计追踪、系统权限清单、参数等。
根据前面法规的内容,针对原始数据和元数据的完整性评价主要包括:系统和数据的安全性、用户等级和权限控制、审计追踪和电子签名、数据备份和还原。下面我们以全自动细胞计数和活率分析仪Vi-CELL BLU为例来一一做下评价。
(1)系统和数据的安全性
首先是控制电脑的操作系统和分析软件的安全性。对于这一点Vi-CELL BLU如何来保证安全性呢?
a 采用一体机的设计,出厂前已安装好Win 10 企业版LTSC操作系统,该系统是微软面向企业用户提供的长期支持版本。不仅减少了系统升级的频次,系统稳定性相对其他版本也更好,而且精简了一些不必要功能,操作上比其他的Win10版本运行更加流畅。
b 出厂统一操作系统版本,保证系统和分析软件的兼容性,不会因为控制电脑所配操作系统的版本差异而出现兼容性方面的报错。
c 系统安装有Application Whitelisting功能,可阻止恶意软件自动或手动安装,保护操作系统的安全。
其次是数据保存的安全性,即数据保存在安全的环境中,不能轻易被删除。通常认为数据储存在数据库中是更加安全且不易被删除的方式,因为所有数据都是以碎片化的方式存储在数据库中。
a Vi-CELL BLU测试条件和分析结果以PostgreSQL数据库形式保存,提高数据安全性;
b 对于普通和高级用户(非管理员用户),开机自动启动Vi-CELL BLU软件进入登录界面,登录后只能在该软件界面上操作,无法退出或关闭软件,无法进入Window界面对系统文件和设置做相关操作;
c 对于普通和高级用户(非管理员用户),在软件操作界面对已测试数据和分析条件无删除权限功能。
只有管理员有权限进入Window界面设置必要的网络连接和在操作软件上做数据的备份和转移。
Vi-CELL BLU操作软件界面(普通和高级用户均无软件退出权限)
(2)用户等级和权限控制
根据2020年施行的《药品记录与数据管理要求》(试行)第二十二条规定,要确保登录用户的唯一性,以及建立操作与系统管理的不同权限。
全自动细胞计数和活率分析仪Vi-CELL BLU为每个用户设置唯一和独立的账号和密码,密码设置有复杂度要求,提高密码安全性。并且可设置多久时间不操作,软件界面自动锁定。同时,软件设置了三个用户等级,分为Normal User,Advanced User和Admin User,每级用户已有相应的权限设定。只有管理员可对其他用户等级进行禁用、激活和更改用户等级的操作。
设置自动锁屏和密码失效时间操作界面
三个用户等级: Normal/Advanced/Admin User
(3)审计追踪和电子签名
根据CGMP的描述,审计追踪(Audit trail)是安全的、计算机产生的、有时间印记的电子记录,依据该记录,可以重建作业者进行创建、修订或删除电子记录等活动的事件过程。
FDA 21 CFR Part 11包括了电子记录和电子签名,是具有法律约束力的法规,分析仪器在生成电子记录时必须遵守该法规。经过21 CFR Part11验证的仪器,软件和程序可以通过多种方式来管理和减轻数据完整性风险。
贝克曼库尔特公司的Vi-CELL BLU操作软件包括了审计日志、样品操作日志、系统报错日志和浓度校准曲线日志等电子记录,并且记录了相应的日期和时间、操作用户名、时间分类和描述,并且任何用户都无权限关闭审计追踪功能,同时软件自带电子签名功能,免费对用户开放。
电子记录查询界面
已完成的电子签名
(4)数据备份和还原
根据《药品生产质量管理规范-附录计算机化系统》第三条 风险管理应当贯穿计算机化系统的生命周期全过程(GAMP5),仪器产生的数据在退役处理前,需要数据的备份。其他数据完整性相关法规也都要求测试的数据需要定期备份,以保护存储的数据供将来调用还原,同时备份的数据应当存在另一个单独和安全的地点。
贝克曼库尔特的Vi-CELL BLU分析软件可设置自动备份的周期和时间,可将需要的数据(包括测试结果和分析条件)定期定时备份到指定文件夹中,根据需要后期再导入到离线软件中还原以供调用查看。
数据自动定期备份的设置界面
(5)其他
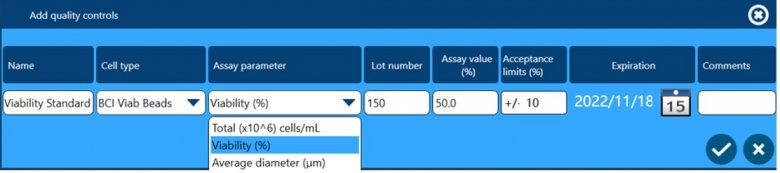
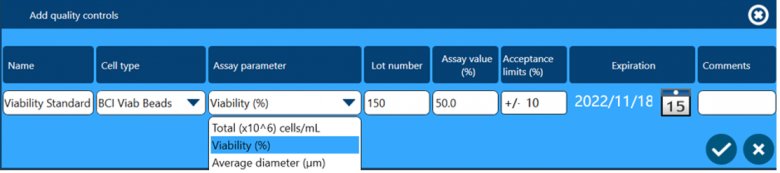
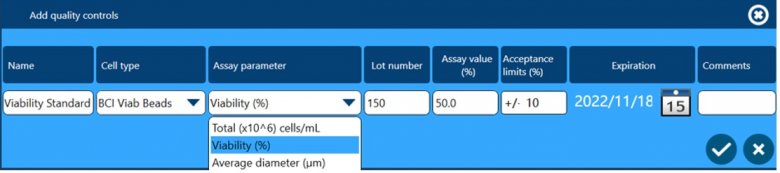
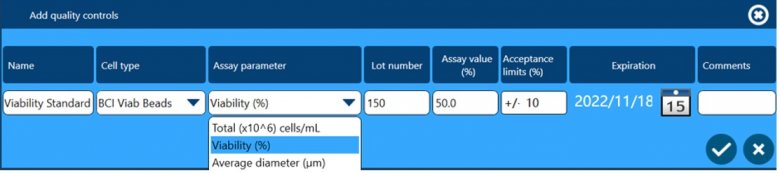
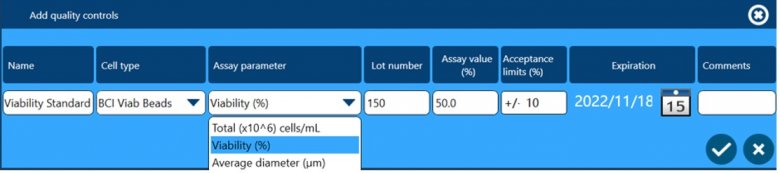
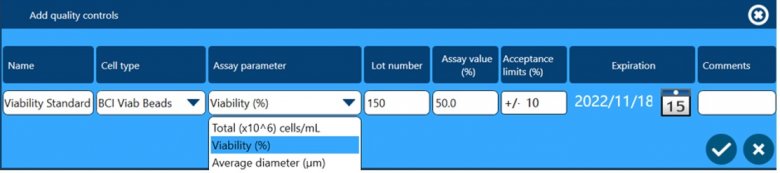
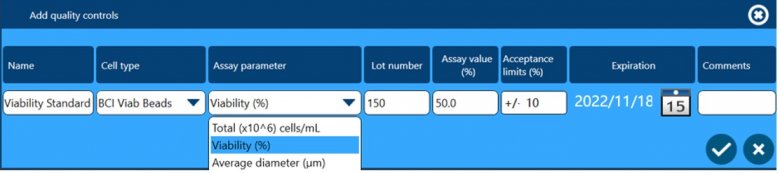
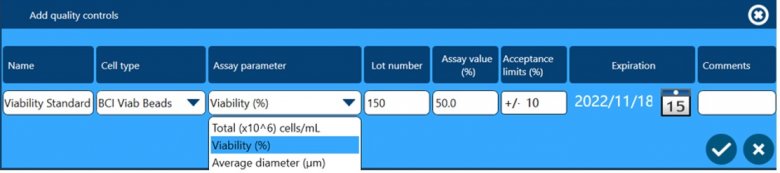
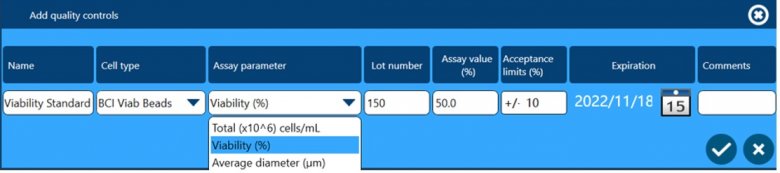
除了以上四个方面保证数据完整性外,全自动细胞计数和活率分析仪Vi-CELL BLU还配套了多种浓度、活率和粒径标样,用户可根据下面窗口设置这些标样作为Quality Control,检测结果可用于监测仪器的日常状态,测试数据会自动储存在软件中,可供后期追溯查看。
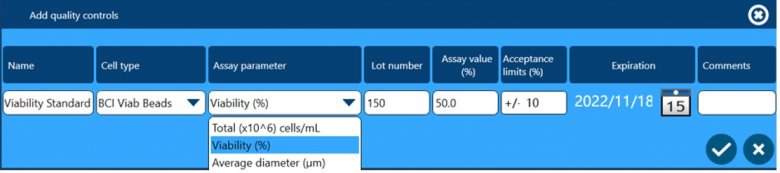
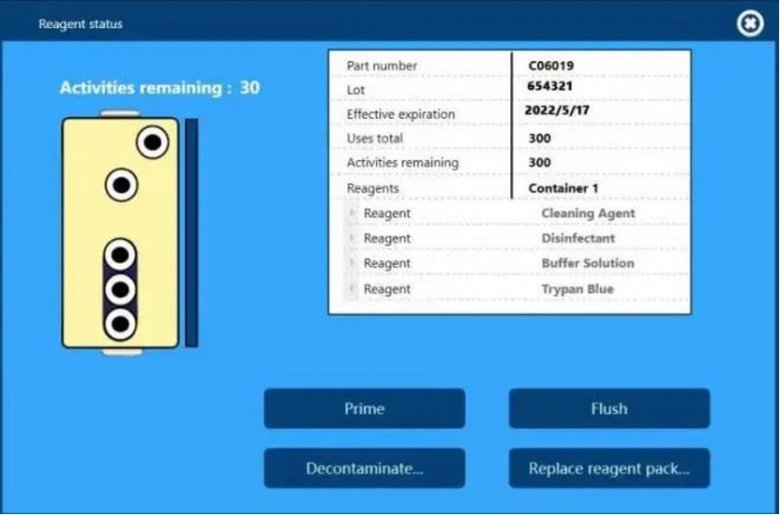
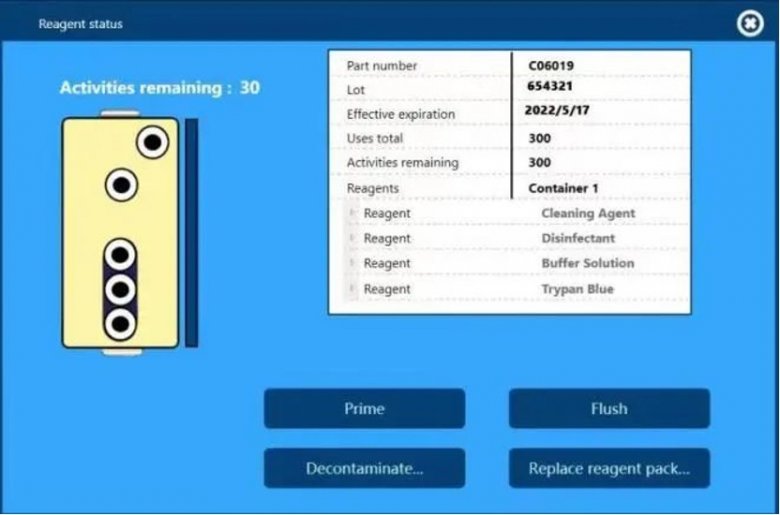
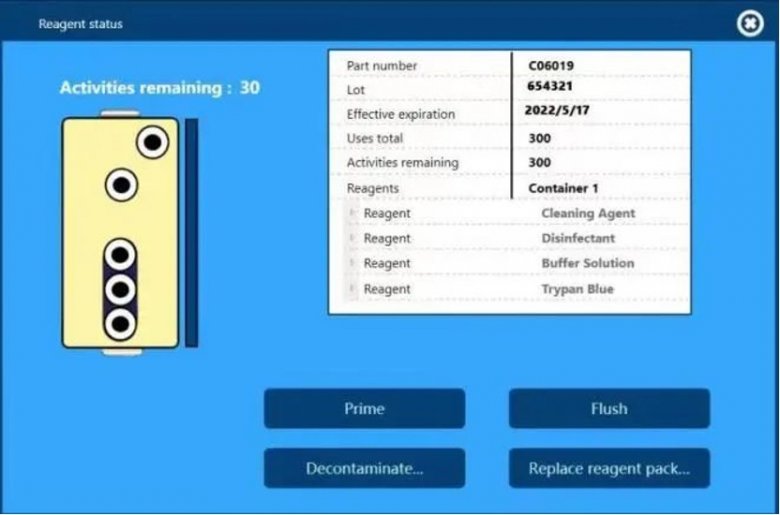
另外,仪器配套的PP材质试剂盒(可用于洁净室)自带RFID芯片,仪器可自动识别并实时追踪试剂盒的编号、批号、使用次数和有效期,并且测试报告中也会留有这些试剂信息,方便后期的数据追溯。
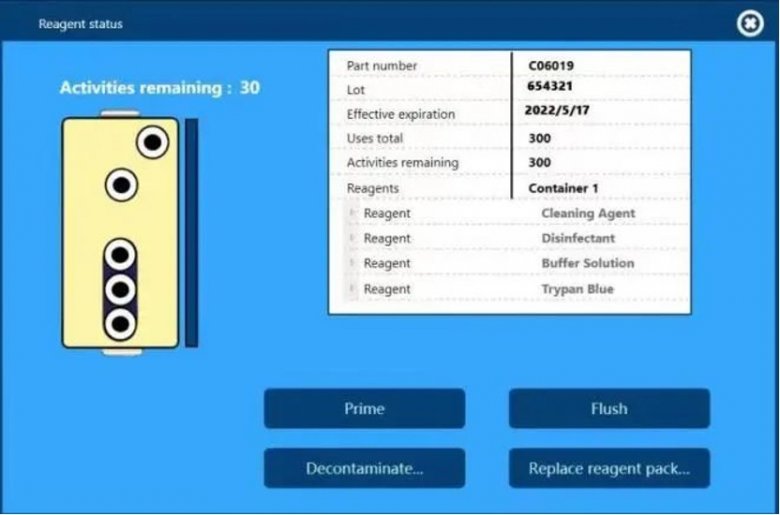
仪器自动识别的试剂盒信息
以上是针对大家经常提到的几个方面的数据完整性内容,通过全自动细胞计数和活率分析仪Vi-CELL BLU做的评估。如您还有其他数据完整性方面的问题需进一步了解,欢迎和我们联系。


