白金会员
白金会员
 已认证
已认证


2020年5月14日,国家药监局发布《开展化学药品注射剂仿制药质量和疗效一致性评价工作》。注射制剂一致性评价正式启动!
2016年3月5日
国务院办公厅发布《关于开展仿制药质量和疗效一致性评价的意见》
2017年8月25日
国家药监局发布《关于仿制药质量和疗效一致性评价工作有关事项的公告》
2018年12月28日
国家药监局发布《关于仿制药质量和疗效一致性评价有关事项的公告》
2019年10月15日
国家药监局公开征求《化学药品注射剂仿制药质量和疗效一致性评价技术要求(征求意见稿)》和《已上市化学药品注射剂仿制药质量和疗效一致性评价申报资料要求(征求意见稿)》意见
2019年10月15日
国家药监局发布《开展化学药品注射剂仿制药质量和疗效一致性评价工作》
论起注射制剂,始终绕不开的话题之一便是不溶性微粒。早在上世纪30年代就有对不溶性微粒引起不良反应的相关报道,通过各方文献,我们已清楚静脉注射制剂中不溶性微粒对人体的危害,主要分为五种:静脉炎等炎症反应、肉芽肿、栓塞、肿瘤、过敏和热原样反应1。日常生活中,我们也会时常听说和看到致死病例的报道。因此,各个国家对不溶性微粒都有严格的质控要求,如我国药典ChP 0903,美国药典USP<787>、<788>、<789>,日本药典JP 6.07 以及欧盟、韩国药典等都明确了对于静脉注射制剂中大于等于10μm和25μm不溶性微粒的数量限值。从制药企业角度讲,其能够自信于产品质量,实现稳步放行也是不溶性微粒说了算。可以说,不溶性微粒的准确、成功检测是实现产品上市的质量关键保障。
2020年4月10日,国家药品不良反应监测中心发布了2019年国家药品不良反应监测报告,该报告全面整理了2019年全国药品不良反应情况,对监测中心收集到的151.4万份《药品不良反应/事件报告表》进行了全面的分析汇总。
通过1999年-2019年的数据汇总,我们可以看到药品不良反应/事件报告数量呈增长趋势,从2012年开始,每年的报告数量都在120万份以上,且逐年增加。
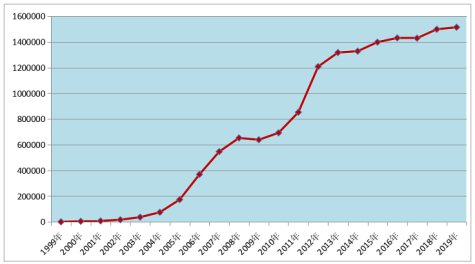
图1 1999年-2019年全国药品不良反应/事件报告数量增长趋势2
对2019年151.4万份进行统计分析,按照给药途径,可以看到注射给药占了62.8%,这其中92.5%是静脉注射给药所造成的不良反应,而其他注射给药仅占7.5%。
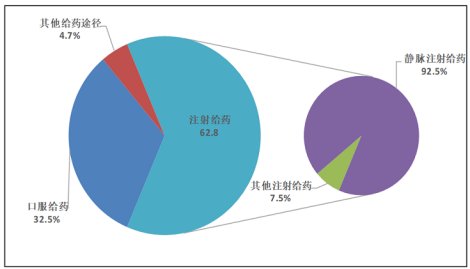
图 2 2019年药品不良反应/事件报告给药途径2
因此,在国家法规、一致性评价和市场对注射制剂产品质量的高要求下,以及和国外的无缝对接需求,对我国制药企业的检测能力就提出了更高的标准和要求,而想要在激烈的注射制剂竞争中突出重围占领制高点,有一款放心的不溶性微粒检测仪便至关重要,而这就是HIAC 9703+专注服务于制药企业的初心和决心!

我们知道,光阻法微粒分析仪源于HIAC,HIAC成功对微粒的准确、快速检测,影响并推动了药典对不溶性微粒检测的要求和发展,时至今日,各国药典规定的不溶性微粒检测第一法均为光阻法。
HIAC 9703+秉承了光阻法的原理并集多检测模式、小体积测试于一身,内置各国药典测试程序,审计追踪完善齐备,可以让您轻松应对各国的严格要求,同时又能保证产品的高质量和检测的低成本。
多 检 测 模 式
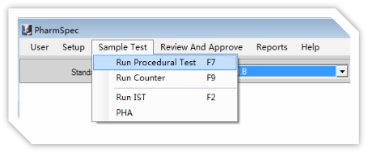
- 自定义测试
随时随地,随意参数测试!
- 药典程序测试
出口?国内?真正实现“全球通”!
- IST测试
USP<1788>功能,轻松校验!
小 体 积 测 试
是否还在为单剂量体积无法满足药典要求而苦恼?
是否还在羡慕美国药典有USP<787>小体积测试推荐?

- 小体积试管夹套件
- 0.047’’ x 3.2’’取样针
- 1mL注射器
真正实现0.1-1000mL任一体积取样、1.3-150μm任一粒径测试分析!
审 计 追 踪 完 善 齐 备
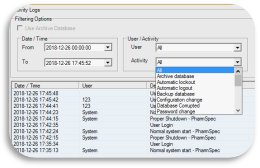
- 所有测试、操作...
“你”有做,“我”有计,丝毫不差。
让您的审计追踪更轻松、更放心,也更合规!
当然,测试结果的直接判定,有效的电子签名,让您在合规的道理上踏歌而行。

不溶性微粒检测创始和传承
HIAC 9703+为您值守终
产品的产品质量!
参考文献:
1. 《小微粒 大祸害 -- 注射液中的不溶性微粒不容忽视》
2. 《国家药品不良反应监测年度报告(2019年)》

点击“阅读原文”获取详细产品信息~